Основные классы ферментов
| Наименование класса | Катализируемые реакции | Примеры |
| Оксидоредуктазы | Восстановительные и окислительные процессы | Глюкозооксидаза, каталаза, алкогольдегидрогеназа |
| Трансферазы | Перенос различных химических групп от одного субстрата к другому | Протеинкиназа, гликогенфосфорилаза, пируваткиназа |
| Гидролазы | Гидролитическое расщепление химических связей субстратов | Протеазы, амилазы, целлюлазы |
| Лиазы | Отщепление химической группы с образованием двойной связи или, например, присоединение химической группы по двойной связи | Аспартаза, фумараза |
| Изомеразы | Изменения в пределах молекулы субстрата | Триизофосфатизомераза |
| Лигазы (синтетазы) | Соединение молекул субстрата с использованием высокоэнергетических соединений, например, АТФ | ДНК-лигаза, триптофансинтетаза |
Ферментативный катализ существенно отличается от неферментативного, в связи с чем в кинетике ферментативных реакций существуют совершенно особые закономерности. Они позволяют выделить ферментативную кинетику в самостоятельный раздел химической кинетики, в котором изучается зависимость скорости реакций, катализируемых ферментами, от концентрации реагирующих веществ (ферментов и субстратов) и от условий их взаимодействия (температуры, рН, концентрации коферментов и кофакторов, наличия различных эффекторов, т.е. активаторов и ингибиторов).
Изучение кинетики ферментативного действия имеет важное теоретическое значение, поскольку только с позиций кинетики можно подойти к решению вопроса о механизме ферментативного действия. Но оно также необходимо с практических позиций, т.к. только имея определенные сведения о кинетике действия того или иного фермента, можно подобрать оптимальные условия для его работы, а также влиять на его активность в заданном направлении на различных стадиях технологического процесса.
Вопросы, связанные с кинетикой ферментативных реакций, детально изложены в специальных разделах биохимии и энзимологии, поэтому основное внимание уделим тем положениям, которые необходимы для грамотного подхода к работе с ферментами: подбору условий для определения активности фермента, определению начальной скорости реакции, выбору субстрата, определению его насыщающей концентрации, оптимуму действия температуры и рН, влиянию кофакторов, активаторов и ингибиторов.
Любая ферментативная реакция идет по схеме:
субстрат ®[фермент]® продукт реакции.
Обозначим исходную мольную долю фермента через ХЕ (величина представляет собой общую концентрацию свободного и связанного фермента в любой момент времени), мольную долю субстрата через - ХS (ХS>>>ХЕ), мольную долю комплекса фермент-субстрат - через ХЕS, мольную долю продукта реакции - через ХР. Для математической интерпретации фермент-субстратного взаимодействия используют классическую модель Микаэлиса-Ментена, суть которой заключается в том, что сначала происходит обратимая реакция между ферментом и субстратом, константа скорости которой k+1 (для прямой) и k-1 (для обратной):
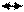 |
ХЕсвоб+ХS
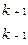 ХES, (3.1)
ХES, (3.1)
где ХЕсвоб= ХЕ- ХES
Затем комплекс ES распадается с образованием продукта Р.
ХES 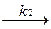 ХР-ХE, (3.2)
ХР-ХE, (3.2)
Следовательно, скорость реакции зависит от констант скорости и концентрации фермента ХЕ и субстрата ХS. Образование комплекса ES происходит со скоростью 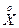 ES.
ES.
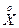 ES=k+1(ХE-ХES) ХS-k-1 ХES-k2 ХES (3.3)
ES=k+1(ХE-ХES) ХS-k-1 ХES-k2 ХES (3.3)
В стационарном режиме при 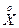 ES=0 имеем:
ES=0 имеем:
ХES= 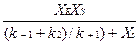 . (3.4)
. (3.4)
Скорость образования продукта реакции:
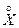 ES= k2ХES=
ES= k2ХES= 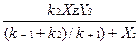 , (3.5)
, (3.5)
где k2XE - максимальная скорость образования продукта реакции.
Отношение (k-1+k2)/k+1 представляет собой константу Микаэлиса-Ментена, которую обозначим kM.
Скорость образования продукта реакции является максимальной при условии, что концентрация субстрата очень высока и не является лимитирующим фактором, либо исходная концентрация фермента равна концентрации комплекса. Последнее условие эквивалентно допущению, что k+1=∞.
Обозначим максимальную скорость образования продукта реакции через 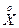 max. Получаем:
max. Получаем:
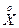 Р=
Р= 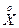 max[XS/ kM+XS]. (3.6)
max[XS/ kM+XS]. (3.6)
Можно показать, что численно константа Микаэлиса-Ментена представляет собой значение концентрации ХS, для которой 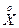 Р=
Р= 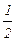
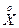 max.
max.
В более общем виде имеем:
kM=[( 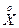 max-ХР)/
max-ХР)/ 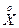 Р] XS (3.7)
Р] XS (3.7)
График зависимости 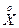 Р от XS представляет собой гиперболу, для которой одна из асимптот есть
Р от XS представляет собой гиперболу, для которой одна из асимптот есть 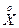 max (рис. 3.1).
max (рис. 3.1).
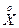 Р Р
| Рис. 3.1. Зависимость скорости ферментативной реакции от концентрации субстрата согласно модели Микаэлиса-Ментена | |||
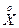 max max
| ||||
| ||||
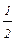 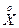 max max
| ||||
| kM | XS |
Таким образом, ход ферментативной реакции во времени не может быть описан одним математическим уравнением, поскольку все ферментативные реакции в самом начале своего протекания (когда имеется избыток субстрата и образовалось мало продуктов реакции) являются реакциями нулевого порядка, и только потом они приобретают характер реакции первого или второго порядка. Скорость реакции нулевого порядка со временем не меняется, зависимость количества образовавшегося продукта от времени остается прямо пропорциональной (рис. 3.2). Для реакций первого порядка скорость реакции в каждый данный момент времени пропорциональна имеющейся в наличии концентрации субстрата, а следовательно, наблюдается постоянное падение скорости реакции с течением времени (рис. 3.3).
В модели Микаэлиса-Ментена предполагается, что при низких концентрациях субстрата реакцию можно считать реакцией первого порядка относительно субстрата и реакцией нулевого порядка относительно фермента. При высоких концентрациях субстрата она становится реакцией нулевого порядка относительно субстрата и первого порядка относительно фермента; при промежуточных концентрациях субстрата, в частности при значениях XS≈k,- реакцией второго порядка.
 |  |


|
|
|
| Рис. 3.2. Графическое изображение реакции нулевого порядка | Рис. 3.3. Графическое изображение реакции первого порядка |
Хотя изложенная модель очень простая, ее использование приводит к результатам, хорошо совпадающим с экспериментальными. Преимущество модели заключается в том, что она описывает процесс ферментации в любой среде при любой температуре. При этом используются только два параметра: константа kM и максимальная скорость реакции 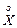 max. На практике эти параметры определяют, измеряя скорости реакции для различных концентраций субстрата. В литературе встречаются и другие модели, в которых, в частности, учитываются возможные ингибирующие факторы.
max. На практике эти параметры определяют, измеряя скорости реакции для различных концентраций субстрата. В литературе встречаются и другие модели, в которых, в частности, учитываются возможные ингибирующие факторы.
Любой ферментный препарат прежде всего должен быть охарактеризован по его ферментативной активности. Комиссия по ферментам Международного биохимического союза рекомендует использовать следующие понятия и выражения единиц активности ферментов:
- стандартная единица активности фермента - такое количество фермента, которое катализирует превращение одного микромоля данного субстрата за одну минуту при заданных условиях. Стандартная единица фермента обозначается буквой Е (от русского слова «единица») или буквой U (от английского слова «unit»);
- удельная активность - число единиц (Е или U), отнесенное к одному миллиграмму белка в ферментном препарате;
- молекулярная активность - число молекул данного субстрата или эквивалентов затронутых групп, превращаемых за одну минуту одной молекулой фермента при оптимальной концентрации субстрата (понятие соответствует числу оборотов, введенных Варбургом, т.е. число молей превращенного субстрата, приходящееся на моль фермента за минуту;
- катал - каталитическая активность, способная осуществлять реакцию со скоростью равной 1 молю в секунду в заданной системе измерения активности.
Каталитическая активность в 1 катал (кат) при практическом применении оказывается слишком большой величиной, поэтому в большинстве случаев каталитические активности выражают в микрокаталах (мккат), нанокаталах (нкат) или пикокаталах (пкат). Стандартная единица фермента находится с каталом в следующем соотношении: 1 Е (U)=16,67 нкат.
Для того чтобы правильно определить потенциальные возможности фермента как катализатора, нужно учитывать скорость ферментативной реакции в тот момент времени, когда факторы, замедляющие скорость ферментативной реакции (нехватка субстрата, специфическое ингибирование продуктами реакции, частичная тепловая денатурация фермента и др.), не успевают проявить свое действие и наблюдается прямая пропорциональная зависимость между продуктами реакции и временем. На практике начальную скорость ферментативной реакции определяют графически, для чего строят кривую хода ферментативной реакции во времени. Начальная скорость определяется как тангенс угла наклона касательной, проведенной из начала координат к кривой ферментативной реакции.
Многие ферменты катализируют реакции с участием двух субстратов. К так называемым бимолекулярным реакциям относятся реакции переноса химических группировок с одного соединения на другое, реакции синтеза, окислительно-восстановительные реакции. Такие реакции могут протекать по двум различным схемам. В реакциях первого типа, называемых реакциями единичного замещения, два субстрата А и В образуют с ферментом комплекс ЕАВ, который затем распадается с образованием продуктов реакции С и Д. Второй тип двухсубстратных реакций протекает схеме двойного замещения (типа «пинг-понг»). В этих реакциях с активным центром фермента в каждый момент времени связан только один из двух субстратов.
На температурной кривой можно обнаружить снижение скорости ферментативной реакции при температурах, превышающих оптимальную. И это зависит, в первую очередь, от денатурации ферментного белка. Именно поэтому очень важным показателем, характеризующим отношение фермента к температуре, является его термостабильность. Термостабильность фермента складывается из двух критериев: величины температуры и продолжительности ее воздействия на фермент. Кроме того, на термостабильность различных ферментов могут оказывать влияние и такие факторы, как рН среды, ее солевой состав, защитное действие субстрата.
Для каждого фермента характерна определенная узкая область значений рН, при которой он проявляет максимальную активность. Форма кривых, описывающих зависимость активности фермента от рН, отражает способность важных для данного фермента протон-донорных или протон-акцепторных групп в активном центре фермента переходить в состояние с требуемой степенью ионизации при определенных значениях рН.
Кроме влияния рН на состояние ионизации активного центра фермента, ход представленных кривых будет зависеть и от других факторов. В частности, изменение рН среды изменяет состояние ионизации субстрата (если это заряженное вещество), комплексов ХЕS и ХЕР, а в некоторых, например, окислительно-восстановительных реакциях, ионы Н+ сами могут принимать участие в реакции. Помимо этого, скорость денатурации ферментативного белка зависит от рН.
При экспериментальном изучении активности фермента от рН следует помнить, что рН-оптимум зависит от состава среды (от природы используемого буфера); оптимумы рН прямой и обратной реакции могут быть совершенно различными; при действии одного и того же фермента на различные субстраты рН-оптимумы также могут быть различными.
Кроме понятия оптимума рН, очень важным является понятие рН-стабильности. Это тот диапазон рН, при котором фермент или ферментативный препарат сохраняет свою активность в течение определенного периода времени. рН-стабильность также зависит от ряда факторов, среди которых, кроме уже названных, форма ферментного препарата, степень его очистки и др. Все вышеизложенное позволяет утверждать, что варьируя температурный режим и изменяя рН, можно в какой-то мере регулировать каталитическую активность фермента.
В ферментативных реакциях большое значение играют активаторы и ингибиторы процесса. Активаторами называют вещества, которые повышают активность ферментов. Хорошим примером таких соединений являются аминокислота цистеин и восстановленный глютатион, содержащие свободную SН-группу. Их активирующее действие заключается в том, что они восстанавливают дисульфидные связи с образованием SН-групп, необходимых для проявления каталитической активности тиоловых ферментов. Кроме того, некоторые ферменты активируются металлами, которые либо участвуют в построении активного центра, либо стабилизируют пространственную конформацию ферментного белка и, тем самым, обеспечивают проявление каталитических функций.
Ингибиторами называют вещества, специфически снижающие активность ферментов. Снижение или полная потеря активности ферментов могут быть вызваны разного рода денатурирующими воздействиями. В этом случае правильнее употреблять термин «инактивация» фермента. Механизм действия ингибиторов может быть самым разнообразным:
- ингибитор взаимодействует с апоферментом, при этом возможны такие варианты, как связывание функциональных групп белка, изменение третичной и четвертичной структуры апофермента, специфическое связывание с определенным участком апофермента, неспецифическая адсорбция на белке;
- ингибитор образует комплекс с субстратом;
- ингибитор связывает кофермент;
- ингибитор связывает активатор;
- ингибитор связывает кофактор.
В свое время Эмиль Фишер, говоря о том, что субстрат подходит к ферменту как «ключ к замку», предполагал, что активный центр фермента имеет совершенно жесткую структуру, комплементарную структуре субстрата. В развитие представлений Э. Фишера американский исследователь Д. Кошланд выдвинул теорию «индуцированного соответствия». Ее суть заключается в следующем. Пока фермент не вступает во взаимодействие с субстратом, структура его активного центра лишь приблизительно комплементарна структуре субстрата; их полная комплементарность наступает лишь в момент их взаимодействия т.е. индуцируется взаимодействием. Таким образом, выводы Э. Фишера о жестком соответствии структуры фермента и субстрата заменяются на представления о гибких, эластичных активных центрах молекул фермента. Теория Кошланда подразумевает, что конформация молекулы фермента и его активного центра может изменяться под влиянием коэнзима и субстрата.
Экспериментальные данные, полученные для ряда ферментов, свидетельствуют о том, что в результате присоединения фермента к субстрату происходит изменение ряда физико-химических показателей ферментного белка.
В настоящее время выделяют четыре основных фактора, определяющие каталитическую активность ферментов.
1. Сближение и ориентация субстрата по отношению к каталитической группе. Другими словами, фермент способен связывать молекулу субстрата таким образом, что атакуемая связь располагается вблизи от каталитической группы и правильно ориентируется относительно нее в пространстве.
2. Напряжение и деформация: индуцированное соответствие. Присоединение субстрата может вызвать конформационные изменения в молекуле фермента, которые приводят к напряжению структуры активного центра, к некоторой деформации связанного субстрата, облегчая тем самым достижение комплексом ХЕS необходимого состояния.
3. Общий кислотно-основной катализ. В активном центре фермента могут находиться группы специфических аминокислотных остатков, которые являются хорошими донорами или акцепторами протонов. Такие кислотные или основные группы представляют собой мощные катализаторы многих органических реакций, протекающих в водных системах.
4. Ковалентный катализ. Некоторые ферменты реагируют со своими субстратами, образуя очень нестабильные, ковалентно связанные фермент-субстратные комплексы, из которых в ходе последующей реакции образуются продукты реакции.
Перечисленные выше четыре фактора, по-видимому, вносят различный вклад в ускорение химических реакции ферментами различных типов. Эти факторы реализуются в разных ферментах в разных сочетаниях, и в результате механизм действия каждого фермента уникален.
В различных пищевых технологиях долгое время применялись лишь препараты свободных ферментов, срок использования которых - один производственный цикл. Однако достижения молекулярной биологии, биохимии и энзимологии привели к тому, что в настоящее время строение и функции многих ферментов изучены очень детально, и это позволило создать теоретическую базу для производства ферментов пролонгированного действия или иммобилизованных ферментов, т.е. связанных ферментных препаратов.
Сущность иммобилизации ферментов заключается в присоединении их в активной форме тем или иным способом к инертной матрице (обычно это нерастворимый полимерный носитель). Иммобилизацию фермента можно определить и как включение молекулы фермента в какую-либо изолированную фазу, которая отделена от фазы свободного раствора, но способна обмениваться находящимися в ней молекулами субстрата, эффектора или кофактора.
Фаза фермента обычно нерастворима в воде и часто представляет собой высокомолекулярный гидрофильный полимер, например, целлюлозу, полиакриламид и т.д. Включение фермента в изолированную фазу осуществляют различными способами: фермент может быть ковалентно связан с этой фазой, адсорбирован на ней или физически включен в нее.
Возможны следующие способы иммобилизации фермента.
1. Ковалентное связывание. Молекула фермента ковалентно связывается с нерастворимым полимером. Полимер может быть в виде порошка или в форме пленки. Иногда молекулы фермента соединяются ковалентными связями друг с другом или с каким-либо инертным белком; при этом образуется нерастворимый, но активный полимерный фермент.
2. Электростатическое связывание. Этот способ иммобилизации основан на использовании электростатических или других нековалентных механизмов связывания.
3. Сополимеризация с помощью многофункциональных реагентов. Связывание молекул фермента с белками (например, с альбумином) или друг с другом осуществляется за счет использования определенных реагентов. В качестве такого многофункционального реагента часто используют глутаровый альдегид, гелеобразующее действие которого известно давно. В этом способе необходимо избегать взаимодействия реагента с активным центром фермента и ингибирования последнего.
4. Включение в полимер. В этом способе фермент не прикреплен к полимеру, но удерживается внутри него, поскольку последний образует вокруг фермента сетеобразную матрицу Ячейки этой матрицы настолько малы, что молекула фермента не может освободиться из сети, но в то же время достаточно велики для проникновения низкомолекулярных субстратов. Примером такого способа иммобилизации могут служить:
- включение в липосомы, когда фермент находится в водном растворе, окруженном фосфолипидным барьером;
- гидрофобное взаимодействие, когда фермент «погружен» в гидрофобную часть двойного липидного слоя.
5. Инкапсулирование. Включение фермента в органическую или неорганическую капсулу, которая представляет собой полупроницаемую мембрану.
Выбор способа иммобилизации ферментов определяется обоснованием подходящего метода. Этот выбор определяется целым рядом факторов, многие из которых невозможно выявить до тех пор, пока метод не будет опробован. Первичный отбор осуществляется обычно эмпирическим путем. Сначала нужно решить, необходим ли для прикрепления фермента специфический носитель, не будет ли процедура иммобилизации инактивировать фермент и сможет ли иммобилизованный фермент действительно функционировать в тех условиях, при которых его предстоит использовать, именно поэтому для успешной иммобилизации следует по возможности принять во внимание следующие факторы:
- фермент должен быть стабильным в условиях реакции;
- реагенты, образующие поперечные сшивки, не должны взаимодействовать с химическими группировками активного центра. В связи с этим молекула поперечно-сшивающего реагента должна быть как можно больших размеров, что будет препятствовать его проникновению в активный центр;
- всегда, когда это осуществимо, необходимо тем или иным способом защищать активный центр фермента (например, обработка тиоловых ферментов глютатионом или цистеином);
- процедура промывания для удаления «непришитого» фермента не должна оказывать влияния на иммобилизованный фермент;
- полимерная матрица не должна являться субстратом для иммобилизованного фермента;
- необходимо учитывать механические свойства носителя, особенно его механическую прочность и физическую форму.
Ферменты животного происхождения выделяют из органов, в которых интенсивно протекают биохимические процессы. Из слизистой желудка получают пепсин, из поджелудочной железы свиней получают смеси трипсина, химотрипсина, липаз и амилаз. Из ферментов растительного происхождения наиболее широко в народном хозяйстве используют амилазы и протеазы.
Трудоемкость и ограниченность ресурсов для получения животных и растительных белков, а также сезонные ограничения (для растительных ферментов) вызвали необходимость изыскания новых способов получения ферментов. Современные методы генетики и генной инженерии позволяют целенаправленно увеличивать выход необходимых ферментов, получаемых микробиологическим путем. Кроме того, среди микроорганизмов можно найти формы, живущие в экстремальных условиях (термофилы, мезофилы). Это обусловливает то, что можно выделить ферменты с улучшенными свойствами: термостабильные, осмоустойчивые и т.д.
Микроорганизмы в качестве продуцентов ферментов представляют особый интерес, поскольку их метаболизм, а, следовательно, и работа ферментных систем осуществляется с высокой скоростью. Многие микроорганизмы выделяют ферменты, которые в большом количестве мигрируют в культуральную среду. Основными промышленными микроорганизмами для производства ферментных препаратов являются плесневые грибы Aspergillus oryzae, Asp. awamori, Asp. niger и др. Они являются активными синтезаторами амилолитических, протеолитических, пектолитических и других ферментов. Аналогичной способностью обладают бактерии видов Bac. mesentericus и др. Способностью активно продуцировать целлюлитические ферменты обладают представители ряда несовершенных грибов родов Alternaria, Trichoderma, Fusarium и др.
С технологической точки зрения очень важно то, что микроорганизмы выделяют ряд ферментов из клеток в окружающую среду. Это существенно облегчает их выделение и чистку. Важным требованием к применяемому продуценту является его способность к образованию большого количества какого-либо одного фермента при незначительном количестве другого фермента. Выделение ферментов из биомассы является сложным процессом. В его основу положены разнообразные методы, использование которых зависит от свойств выделяемого фермента. К подобным методам относят высаливание, осаждение под действием растворителей, высокомолекулярных соединений, температуры или ионов Н+, металлов.
В производстве ферментных препаратов используются комплексные среды, являющиеся смесью синтетических сред с естественными материалами растительного, животного и микробного происхождения.
Применяют два способа выращивания продуцентов ферментов: поверхностный (предусматривает выращивание микроорганизмов, главным образом плесневых грибов на поверхности твердых, полужидких или сыпучих материалах, и создает хорошие условия для максимального контакта микроорганизмов с кислородом воздуха) и глубинный (предусматривает выращивание микроорганизмов на жидких средах при использовании в качестве продуцентов ферментов микроорганизмов, способных интенсивно развиваться в условиях недостаточного контакта клеток с кислородом).
Синтетические среды готовят из различных минеральных солей и органических соединений, являющихся источником углерода,- углеводов, спиртов, органических кислот. В качестве естественных материалов применяются отходы пищевых производств: отруби, меласса, жмыхи, кукурузный экстракт, солодовые ростки, пивные дрожжи, зерно-картофельная барда и др. Для накопления ферментов в культуральной среде необходимы оптимальные условия для их синтеза; оптимальный состав среды; температуру; значение рН, снабжение клеток кислородом воздуха, удаление продуктов обмена.
При поверхностном способе выращивания ферменты из питательной среды экстрагируют водой, отделяют от твердой фазы, сгущают до концентрации сухих веществ 50 %. При глубинном культивировании отделяют клетки микроорганизмов от культуральной жидкости фильтрацией или центрифугированием. Фильтрат или центрифугат сгущают до концентрации сухих веществ 40 %. Полученные таким образом концентраты ферментов представляют собой технические ферментные препараты, которые могут использоваться в жидком виде или после высушивания в виде порошка. Для очистки ферментов применяется осаждение их из водных растворов органическими и неорганическими растворителями (метиловым эфиром, изопропиловым спиртом, ацетоном, сульфатами аммония, натрия, цинка, хлоридом натрия). Высушивание предварительно очищенных и сконцентрированных препаратов осуществляют в распылительных сушилках или методом сублимации.
Ферментные препараты представляют собой концентраты ферментов, полученные с помощью микроорганизмов, содержащие в своем составе наряду с ферментами балластные вещества. Выпускают ферментные препараты в виде жидкостей с концентрацией сухих веществ не менее 50 %, либо порошков белого, серого или желтого цвета, имеющих определенную ферментативную активность. Ферментные препараты применяются в производствах как катализаторы соответствующих биохимических процессов.
Дата добавления: 2016-03-22; просмотров: 2661;
