Количественное определение. 1. Комплексонометрический метод
1. Комплексонометрический метод. Вариант прямого титрования. Метод основан на свойстве ионов магния количественно вступать в реакцию с комплексоном (трилоном Б) с образованием прочных, растворимых в воде, бесцветных внутрикомплексных соединений.
Титрант: раствор трилона Б – динатриевая соль этилендиаминотетрауксусной кислоты (сокращенно – Na2H2ТrБ).
Индикаторы: металлоиндикаторы – органические красители, имеющие различную окраску в свободном виде и виде комплекса с металлом, который менее прочный, чем комплекс трилона Б с металлом. Изменение окраски металлоиндикаторов зависит от pH среды.
Определение солей магния проводят в среде аммиачного буфера при рН 9,5-10,0. Индикатор – кислотный хром черный специальный (эриохром черный Т). Переход окраски от красно-фиолетовой к синей.
Магния оксид предварительно растворяют в кислоте хлороводородной разведенной.
Mg2+ + H2Ind MgInd + 2H+
Окраска раствора за счет
комплекса металла с индикатором
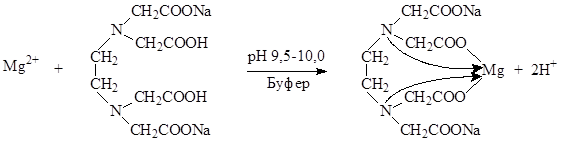
В точке эквивалентности:
MgInd + Na2H2ТrБ MgNa2ТrБ + H2Ind
Окраска раствора за счет
свободного индикатора
fэкв (ЛВ) = 1
2. Ацидиметрический метод нейтрализации (вариант обратного титрования). Используется для количественного определения магния оксида. Метод основан на свойстве магния оксида количественно взаимодействовать с кислотой хлороводородной с образованием соли:
MgO + 2HCI → MgCI2 + 2H2O
Избыток
HCI + NaOH → NaCI + H2O
Остаток
fэкв (магния оксида) = Ѕ
Хранение
По общему списку, в хорошо укупоренной таре. Магния сульфат при нарушении условий хранения постепенно теряет кристаллизационную воду (выветривается); магния оксид взаимодействует с углекислым газом и влагой, содержащимися в воздухе, образуя примесь карбоната и магния гидроксида:
MgO + CO2 → MgCO3
MgO + H2O → Mg(OH)2
Применение
Магния оксид – антацидное средство с легким послабляющим эффектом.
Магния сульфат – спазмолитическое, противосудорожное, успокаивающее, желчегонное и слабительное средство.
СОЕДИНЕНИЯ КАЛЬЦИЯ
| Лекарственное вещество. Химическая формула | МНН и латинское название | Формы выпуска |
| Кальция хлорид CаCI2 6H2O | Calcium chloride* Calcii chloridum | Субстанция; раствор для инъекций 10% |
| Кальция сульфат жженый (гипс медицинский) CaSO4 0,5H2O | Calcium sulfate* Calcii sulfas ustus | Субстанция |
Получение
Кальция хлорид получают из природного минерала – кальцита:
CaCO3 + 2HCI → CaCI2 + CO2↑ + H2O
Сопутствующие примеси (соли железа и магния) осаждают раствором кальция гидроксида:
2FeCI3 + 3Ca(OH)2 → 2Fe(OH)3↓ + 3CaCI2
MgСI2 + Ca(ОН)2 → Mg(ОН)2↓ + СаСI2
Осадки железа и магния гидроксидов отфильтровывают.
Избыток кальция гидроксида нейтрализуют кислотой хлороводородной разведенной:
Ca(ОН)2 + 2HCI → CaCI2 + 2H2O
Кальция сульфат жженый получают из природного минерала – гипса дигидрата (CaSO4 2H2O). При нагревании до 150 0С гипс природный теряет часть кристаллизационной воды и превращается в гипс медицинский:
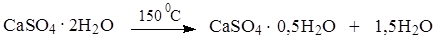
Дата добавления: 2016-03-20; просмотров: 13405;
