Количественное определение. Ацидиметрический метод вытеснения– основан на свойстве слабой угольной кислоты вытесняться из солей при действии сильной минеральной кислоты.
Ацидиметрический метод вытеснения– основан на свойстве слабой угольной кислоты вытесняться из солей при действии сильной минеральной кислоты.
Для натрия гидрокарбоната используют вариант прямого титрования, индикатор – метиловый оранжевый.
NaHCO3 + HCl → NaCl + CO2 + H2O
fэкв.(натрия гидрокарбоната) =1
Лития карбонат определяют по варианту обратного титрования, так как он трудно растворим в воде:
Li2CO3 + 2HCl → 2LiCl + CO2 + H2O
Избыток
HCl + NaOH → NaCl + H2O
Остаток
fэкв.(лития карбоната) = 1/2
Хранение
В хорошо укупоренной таре в сухом месте. Натрия гидрокарбонат во влажном воздухе при повышенной температуре постепенно разлагается с образованием натрия карбоната:
2NaHCO3 Na2CO3 + CO2 + H2O
Применение
Натрия гидрокарбонат – антацидное средство (применяется при повышенной кислотности желудочного сока); отхаркивающее средство. Наружно применяется как антисептическое средство в виде водных растворов для полосканий и промываний.
Лития карбонат – психотропное средство.
Формы выпуска
Натрия гирокарбонат – субстанция; таблетки 0,5 и 0,3 г; входит в состав комплексных таблеток.
Лития карбонат – субстанция; таблетки 0,3 г, покрытые оболочкой.
СОЕДИНЕНИЯ АЗОТА
Натрия нитрит Sodium nitrite(МНН)
NaNO2 Natrii nitris(ЛН)
Получение
Получают из отходов производства кислоты азотной – диоксида азота, который поглощают раствором натрия карбоната:
2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2
Образовавшуюся смесь натрия нитрита и натрия нитрата разделяют фракционной перекристаллизацией (натрия нитрат хуже растворятся в воде).
Описание и растворимость
Белые или белые со слабым желтоватым оттенком кристаллы.
Гигроскопичен. Легко растворим в воде. Водный раствор имеет слабощелочную реакцию среды. Трудно растворим в спирте.
Химические свойства
Натрия нитрит проявляет как окислительные, так и восстановительные свойства.
При взаимодействии с восстановителями нитрит-ион восстанавливается до оксида азота (II):
NO2─ + 2H+ +ē → NO + H2O
При взаимодействии с окислителями нитрит-ион окисляется до нитрат-иона:
NO2─ + H2O 2ē → NO3─ + 2H+
Подлинность
1. Реакции на ион натрия – см. с. 24.
2. Реакции на нитрит-ион:
2.1. С дифениламином в присутствии кислоты серной концентрированной наблюдается синее окрашивание. Реакция основана на окислительных свойствах нитрит-ионов. Уравнение реакции см. с. 10.
2.2. С кислотой серной разведенной. Происходит разложение с выде-лением желто-коричневых паров оксида азота (IV).
2NaNO2 + H2SO4 → NO + NO2 + Na2SO4 + H2O
2.3. С антипирином в присутствии кислоты хлороводородной разведенной. Реакция основана на электрофильном замещении атома водорода антипирина на нитрозо-группу:
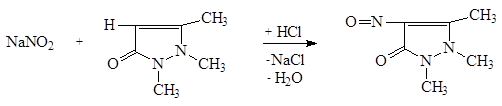
Нитрозоантипирин
(изумрудно-зеленое окрашивание)
Чистота
Определяют общие примеси – хлориды, сульфаты, тяжелые металлы.
Дата добавления: 2016-03-20; просмотров: 3834;
