Количественное определене
1. Аргентометрический метод. Основан на свойстве галогенид-ионов количественно осаждаться серебра нитратом с образованием галогенидов серебра.
MeHal + AgNO3 → AgHal + MeNO3
fэкв (ЛВ) = 1
1.1. Натрия хлорид, калия хлорид, натрия бромид, калия бромид.
Вариант Мора (прямое титрование); индикатор – калия хромат. Среда – нейтральная.
NaСI + AgNO3 → AgCI + NaNO3
NaBr + AgNO3 → AgBr + NaNO3
Индикация: 2AgNO3 + K2CrO4 Ag2CrO4 + 2KNO3
Осадок коричневато- красного цвета
Метод может быть использован для количественного определения хлоридов и бромидов в ЛП, содержащих ЛВ слабо-основного характера (например, натрия бензоат), создающих слабо-щелочную реакцию среды.
Натрия йодид и калия йодид не определяют, т.к. йодиды адсорбируются на осадке AgI, окраска появиться до точки эквивалентности (заниженные результаты).
1.2. Натрия йодид, калия йодид.
1.2.1. Вариант Фаянса (прямое титрование); индикатор – натрия эозинат (адсорбционный индикатор). Среда – уксуснокислая (разбавленная CH3cooh).
а) NaInd Ind + Na+
Эозинат натрия
б) NaI + AgNO3 AgI + NaNO3
в) Ind- + AgI + AgNO3 [(AgI)Ag+]Ind + NO
Изб. капля Розовый осадок
Вариант Фаянса может быть применен для определения хлоридов и бромидов натрия и калия. В качестве индикаторов используются бромфеноловый синий и флуоресцеин. Натрия эозинат не применяют, т.к. он адсорбируется на осадках AgCI и AgBr раньше точки эквивалентности.
1.2.2. Вариант Кольтгофа(прямое титрование). Используется для определения натрия и калия йодидов (селективный метод) в многокомпонентных ЛП, содержащих другие галогениды (например, NaСI, KСI, CaCl2, NaBr, KBr). Титрант: раствор серебра нитрата.
Индикатор: йодкрахмальный – 1 капля раствора калия йодата
(0,1 моль/л) УЧ (1/6 KIO3), раствор крахмала (2 мл) и по каплям разведенной кислоты серной до появления синего окрашивания.
KIO3 + 5KI + 3H2SO4 → 3I2 + 3K2 SO4 + 3H2O Уравнение
I2 + КI + крахмал синее окрашивание индикации
По мере титрования из раствора осаждаются йодиды, связываясь с серебра нитратом:
KI + AgNO3 → AgI + KNO3
В точке эквивалентности происходит обесцвечивание раствора, т. к. йодиды полностью исчезнут из раствора.
Хлориды и бромиды не мешают определению, т.к. могут осаждаться только после йодид-ионов (ПР AgI = 1,5 1016; ПР AgBr = 4,4 1013; ПР AgCI = 1,8 1010).
1.3. Для количественного определения натрия и калия хлоридов, бромидов и йодидов в ЛП используются также варианты:
1.3.1. Фольгарда (обратное титрование).
1.3.2. Фольгарда в модификации Кольтгофа (косвенный или видоизмененный вариант Фольгарда).
(См. МУ «Фармацевтический анализ по функциональным группам и общие титриметрические методы анализа, Пермь, 2008 – с. 85-87).
Аргентометрический метод дает точные результаты, быстр в выполнении. Недостаток: титрант серебра нитрат – дорогостоящий реактив, поэтому метод не экономичен.
2. Меркуриметрический метод. Основан на свойстве галогенид-ионов количественно взаимодействовать с солями ртути (II) с образованием труднодиссоциируемых (малоионизированных) галогенидов ртути (II).
Применяют для всех галогенидов натрия и калия.
Титранты– легко ионизированные соли ртути (II): ртути (II) нитрат – Hg(NO3)2, ртути (II) перхлорат – Hg(CIO4)2.
2MeHal + Hg(NO3)2 → HgHal2 + 2MeNO3
fэкв(MeHal) = 1
Среда: азотнокислая.
Индикатор: дифенилкарбазон.
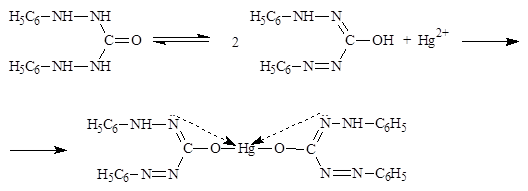
Светло-сиреневое окрашивание
Йодиды натрия и калия титруют в присутствии этанола, концентрация которого в конце титрования должна быть не менее 55%, т.к. ртути йодид мало растворим в воде и имеет ярко-красную окраску осадка, что затрудняет фиксирование точки эквивалентности. Используется свойство ртути (II) йодида растворяться в спирте с образованием бесцветных растворов.
Титрант: ртути (II) перхлорат (0,01 моль/л) УЧ [1/2 Hg(ClO4)2]
2KI + Hg(ClO4)2 HgI2 + 2KClO4
Спирт : вода (1:1)
fэкв (ЛВ) = 1
3. Броматометрический метод. Используется в анализе йодидов калия и натрия.
Метод основан на восстановительных свойствах йодидов. Йодид-ионы окисляются калия броматом в среде кислоты хлороводородной до йодмонохлорида:
6KI + KBrO3 + 6HCI → 3I2 + 6KCI + KBr + 3H2O
3I2 + KBrO3 + 6HCI → 6ICI + KBr + 3H2O
Суммарное уравнение:
6KI + 2KBrO3 + 12HCI → 6ICI + 2KBr + 6KCI + 6H2O
Уравнение после сокращения коэффициентов:
3KI + KBrO3 + 6HCI → 3ICI + KBr + 3KCI + 3H2O
fэкв (MeI) = 1/2 (IЇ –2ē → I+)
Хранение
В хорошо укупоренной таре, в сухом месте (натрия бромид и йодид, калия йодид – гигроскопичны). Бромиды и йодиды легко окисляются до свободного галогена, поэтому их необходимо предохранять от действия света (хранят в склянках темного стекла).
Применение
Натрия хлорид. Плазмозамещающее, дезинтоксикационное, гидратирующее, нормализующее кислотно-щелочное состояние (КЩС) средство.
Калия хлорид. Нормализует КЩС, восполняет дефицит калия.
Натрия бромид и калия бромид. Седативные средства.
Натрия йодид и калия йодид. Восполняют дефицит йода. Проявляют противомикробное, протеолитическое, муколитическое действие.
Натрия фторид Sodium fluoride (МНН)
NaF Natrii phthoridum(ЛН)
Получение
Из минерала флюорита (CaF2,), который сплавляют с натрия карбонатом и кремния (IV) оксидом:
CaF2 + Na2CO3 + SiO2 → 2NaF + CaSiO3 + CO2
Натрия фторид вымывают из плава водой и раствор упаривают до кристаллизации.
Дата добавления: 2016-03-20; просмотров: 6614;
