Описание и растворимость
Бесцветные или белые кристаллические порошки без запаха, соленого вкуса. Натрия бромид, натрия и калия йодиды гигроскопичны. Все ЛВ легко растворимы в воде. Йодиды легко растворимы в этаноле и глицерине.
Подлинность
Выполняют качественные реакции на соответствующие катионы и анионы.
Реакции на катионы:
Na+
1. Реакция осаждения цинка уранилацетатом в среде кислоты уксусной:
NaHal + Zn[(UO2)3(CH3COO)8] + CH3COOH + 9H2O →
NaZn[(UO2)3(CH3COO)9] 9H2O + НHal
Желтый кристаллический осадок
2. Соли натрия окрашивают бесцветное пламя в желтый цвет.
3. Микрокристаллическая реакция с кислотой пикриновой:
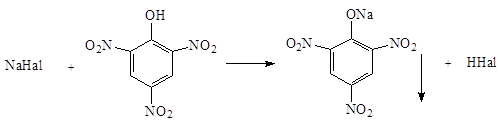
Образуется осадок натрия пикрата желтого цвета в виде игольчатых кристаллов, выходящих из одной точки.
К+
1. Реакция осаждения кислотой виннокаменной. Условия проведения реакции: охлаждение и потирание стеклянной палочкой.
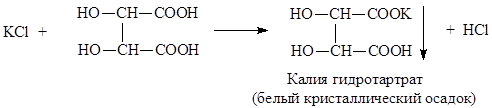
Осадок калия гидротартрата растворим в разведенных минеральных кислотах и в растворах натрия или калия гидроксида. Для связывания выделяющейся галогенводородной кислоты добавляют натрия ацетат:
HCI + CH3COONa NaCI + CH3COOH
2. Реакция осаждения натрия гексанитрокобальтатом (III) в уксуснокислой среде. Образуется желтый кристаллический осадок:
2KHal + Na3[Co(NO2)6] → K2Na[Co(NO2)6] + 2NaHal
Калия, натрия (2:1)
гексанитрокобальтат (III)
3 Соли калия окрашивают бесцветное пламя в фиолетовый цвет или при рассматривании через синее стекло – в пурпурно-красный.
Реакции на анионы:
1. Реакция осаждения серебра нитратом; проводится в азотнокислой среде:
(HNO3)
MeHal + AgNO3 AgHal + MeNO3
AgCI↓ – белый творожистый осадок, нерастворимый в кислоте азотной разведенной и растворимый в растворе аммиака:
AgCI↓ + 2NH4OH → [Ag(NH3)2]CI + 2H2O
AgBr↓ – желтоватый творожистый осадок, нерастворимый в кислоте азотной разведенной и трудно растворимый в растворе аммиака.
AgI↓ – желтый творожистый осадок, нерастворимый в кислоте азотной разведенной и в растворе аммиака.
2. Реакции окисления галогенид-ионов (бромидов и йодидов) до свободных галогенов. Основаны на восстановительных свойствах галогенид-ионов:
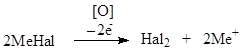
Образующиеся галогены извлекают в хлороформ и наблюдают окраску хлороформного слоя.
Галогениды отличаются по силе восстановительных свойств.
Хлориды являются очень слабыми восстановителями (Ео Cl2/2Cl–
+1,36 В). Окисляются лишь сильными окислителями, при нагревании; образующийся хлор доказать трудно. Поэтому для доказательства хлоридов реакция окисления обычно не используется
Бромиды обладают более выраженными восстановительными свойствами (Ео Br2/2Br– +1,09 В); окисляются только сильными окислителями (KMnO4, Cl2).
Йодиды являются сильными восстановителями (Ео I2/2I– +0,54 В); окисляются и сильными, и слабыми окислителями.
2.1. Для доказательства бромид-иона в качестве окислителя используют раствор хлорамина в присутствии кислоты хлороводородной разведенной:
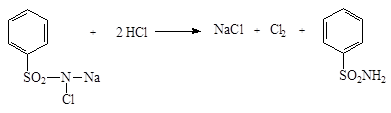
2KBr + CI2 → Br2 + 2KCI
Слой хлороформа окрашивается в желто-оранжевый цвет.
2.2. Для подтверждения подлинности йодид-ионов в качестве реагента используют слабые окислители, которые окисляют йодиды, но не окисляют бромид-ионы и хлорид-ионы (т.е. избирательные окислители).
2.2.1. Раствор железа (III) хлорида или раствор натрия нитрита:
2NaI + 2FeCI3 → I2 + 2FeCI2 + 2NaCI
2KI + 2NaNO2 + 2H2SO4 → I2 + K2 SO4 + Na2SO4 + 2NO↑ + 2H2O
Слой хлороформа окрашивается в фиолетовый цвет.
2.2.2. Кислота серная концентрированная:
2NaI + H2SO4 → Na2SO3 + I2 + H2O
Наблюдают выделение фиолетовых паров йода.
Чистота
Все шесть ЛВ подвергают следующим испытаниям:
1. Прозрачность и цветность водного раствора (должны быть прозрачными и бесцветными).
2. Кислотность или щелочность водного раствора (должны иметь нейтральную реакцию среды).
3. Предельное содержание общих примесей (железо, тяжелые металлы, сульфаты, мышьяк).
4. Отсутствие катионов бария и кальция (не должно появляться мути при добавлении к раствору ЛВ кислоты серной разведенной).
5. Потеря в массе при высушивании.
В отдельных ЛВ дополнительно проверяют отсутствие специфических примесей.
Натрия хлорид, калия хлорид.
1. Отсутствие магния (Mg2+) (с Na2HPO4 и NH4OH) и аммония (NH4+) (с реактивом Несслера).
2. В натрия хлориде – отсутствие калия (К+) (реакция с виннокаменной кислотой); в калия хлориде – отсутствие натрия (Na+) (по окрашиванию пламени), т.к. Na+ и К+ являются физиологическими антагонистами.
Натрия бромид, калия бромид (MeBr).
1. Отсутствие йодидов (I–). К раствору ЛВ прибавляют FeCl3 и крахмал; не должно быть синего окрашивания.
При наличии примеси:
2MeI + 2FeCl3 → I2 + 2FeCl2 + 2MeCl
I2 + крахмал → синее окрашивание
Сами ЛВ железа (III) хлоридом не окисляются.
2. Отсутствие броматов (BrO3–). К раствору ЛВ прибавляют кислоту серную разведенную; не должно быть желтого окрашивания.
При наличии примеси:
MeBrO3 + 5MeBr + 3H2SO4 → 3Br2 + 3Me2SO4 + 3H2O
(Примесь) (ЛВ) (Реактив) (Желтое
окрашивание)
Натрия йодид, калия йодид (MeI).
1. Отсутствие цианидов (СN–). При добавлении к раствору ЛВ FeSO4 и FeCl3 не должно появляться синего окрашивания. В присутствии примеси образуется железа (III) гексацианоферрат (II) (см. с. 18).
2. Отсутствие йодатов (IO3–). К раствору ЛВ прибавляют кислоту серную разведенную и крахмал; не должно появляться синего окрашивания.
В присутствии примеси:
MeIO3 + 5MeI + 3H2SO4 → 3I2 + 3Me2SO4 + 3H2O
(Примесь) (ЛВ) (Реактив)
I2 + крахмал → синее окрашивание
3. Отсутствие тиосульфат (S2O32–) и сульфит (SO32–)-ионов. К раствору ЛВ прибавляют крахмал и 1 каплю раствора йода (0,1 моль/л) УЧ (Ѕ I2); должно появиться синее окрашивание.
I2 + крахмал → синее окрашивание
В присутствии примесей йод восстанавливается до йодида:
I2 + 2Na2S2O3 → 2НI + Na2S4O6
I2 + Na2SO3 + H2O → 2НI + Na2SO4
4. Отсутствие нитратов (NO3–). При нагревании ЛВ с цинком в щелочной среде не должен выделяться аммиак (красная лакмусовая бумага не должна окрашиваться в синий цвет).
При наличии примеси протекает реакция окисления-восстановления:
NaNO3 + 4Zn + 7NaOH → NH3↑ + 4Na2ZnO2 + 2H2O
Дата добавления: 2016-03-20; просмотров: 3012;
