Кислотно-основні властивості спиртів
Зв’язок ОН- у спиртах досить полярний, тому спирти дисоціюють із утворенням протонів, через що вони проявляють кислотні властивості.
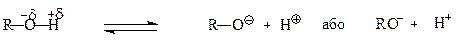
Однак, кислотні властивості спиртів нижчі, ніж у води.
Кислотність спиртів підтверджується взаємодією їх з лужними металами (К, Na, тощо). При цьому утворюються алкоголяти, R—ОNa:

У водному середовищі алкоголяти легко гідролізують, тому одержати їх взаємодією спирту з лугом неможливо
R—ONa + H2O  R—OH + NaOH
R—OH + NaOH
Що ж таке кислотність і від чого вона залежить?
Чим краще молекула спирту дисоціює та іони, тим більшою буде концентрація іонів водню, а значить і вищою буде кислотність спирту. Здатність до дисоціації спиртів залежить, в першу чергу, від полярності Н—О-зв’язку, різної для первинних, вторинних та третинних спиртів та стабільності алкоксилат-аніонів RO, що утворюються в результаті дисоціації. Чим полярніший Н—О-зв’язок та чим стабільніший аніон, тим краще спирт дисоціює і тим вищі його кислотні властивості.
Порівняємо стабільність аніонів, що утворюються при дисоціації первинного (СН3СН2ОН), вторинного [(СН3)2СНОН], третинного [(СН3)3СОН] спиртів та води (НОН).
Відомо, що стабільність зарядженої частинки визначається можливістю делокалізації (розосередження) її заряду. Якщо заряд делокалізований, то частинка є стабільною, якщо ж він зконцентрований на одному атомі – частинка нестабільна.
В етоксилатному аніоні (СН3→СН2→О¯) делокалізації негативного заряду атома кисню протидіє +І-ефект метильної групи (позначений стрілкою). Отже, етоксилатний аніон має меншу стабільність, ніж гідроксилатний аніон ( НО¯ ), що утворюється при дисоціації води.
При наявності двох електронодонорних метильних груп, а тим більше трьох делокалізація негативного заряду буде ще гіршою.
Отже, аніони, що утворюються з наведених вище спиртів за зменшенням стабільності можна розташувати в ряд:
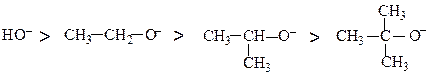
З цього ряду витікає, що спирти є слабшими кислотами, ніж вода, їх кислотність зменшується в ряді: первинний > вторинний > третинний.
При наявності сильних електроно-акцепторних груп при атомі вуглецю, зв’язаному з атомом кисню, кислотні властивості спиртів зростають. Так, трифторометанол є доволі сильною кислотою завдяки відносно високій стабільності трифторометоксилатного аніона:
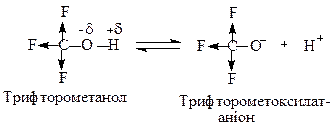
Поряд з кислотними властивостями, спирти проявляють основні властивості за рахунок наявності на атомі кисню двох неподілених пар електронів (за теорією Льюїса основи - це донори електронів).
Тому електронодонорні замісники збільшують основність спиртів, а електроно-акцепторні зменшують. Отже, основність спиртів, на відміну від кислотності, зростає від первинних до третинних. Утворені алкоксонієві іони можуть легко відщеплювати воду, перетворюючись у карбокатіони (див.стор. ).
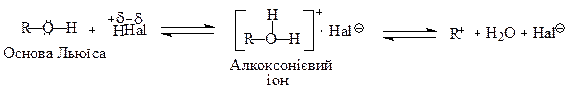
Таким чином, спиртам характерні амфотерні властивості; слабка кислотність або основність будуть переважати, залежно від природи спирту. Крім того, наявність неподілених пар електронів на атомі кисню надає їм нуклеофільності. Особливо сильні нуклеофіли алкоксианіони R—O–, які утворюються при дисоціації алкоголятів:
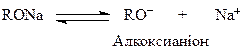
Дата добавления: 2016-02-13; просмотров: 2801;
