Структура, свойства и функции гемоглобина.
Гемоглобин входит в состав эритроцитов и заполняет большую часть их внутриклеточного пространства. Основная функция гемоглобина связана с транспортом газов (кислорода и углекислого газа) в крови человека. Кроме этого, гемогобин участвует в поддержании кислотно-основного равновесия в организме человека и животных, образуя самую мощную гемоглобиновую буферную систему крови.
В настоящее время достаточно хорошо изучены структура и свойства гемоглобина. У взрослого человека в крови различают следующие физиологические типы гемоглобина:
1. Гемоглобин A1 (HbA1 – от англ. adult – взрослый), содержание которого составляет 96 % от общего содержания гемоглобина (Hb).
2. Гемоглобин A2 (HbA2) - содержание составляет до 2,5 %.
3. Фетальный гемоглобин (HbF от англ. fеtus - плод) составляет 1,5 - 2 %.
HbF явяляется главным гемоглобином у плода и у новорожденных, так как его содержание у новорожденных достигает до 80 %, но затем в первые три месяца после рождения он почти полностью заменяется на HbA.
На рис. 1 схематично представлена структура молекулы гемоглобина.
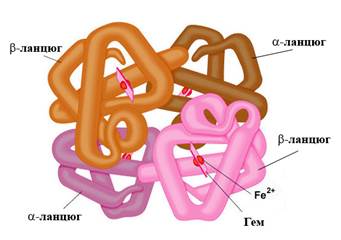
Рис. 1. Модель молекулы гемоглобина (HbA1) (ланцюг с укр. - цепь).
Молекула гемоглобина взрослого человека HbA1 состоит из четырех полипептидных цепей, каждая из которых связана с одним гемом. Белковая часть молекулы гемоглобина имеет название "глобин".
В состав HbA1 входят 2a- и 2b-цепи, которые являются продуктами экспрессии двух разных генов, и потому они имеют разную первичную структуру. В состав a-цепи входит 141, а в состав b-цепи - 146 аминокислотных остатков. Субъединицы гемоглобина, каждая содержит одну полипептидную цепь и один гем, по своей конформации напоминают структуру молекулы миоглобина (рис. 7). Схематично гемоглобин А1 записывают так: HbA1 = α2β2. В гемоглобине А2 вместо β субъединиц находятся δ-субъединицы: HbA2 = α2δ2, а в фетальном гемоглобине - γ-субъединицы, то есть HbF = α2γ2.
При образовании четвертичной структуры гемоглобина возникают многочисленные нековалентные связи между отдельными полипептидными цепями глобина. Наибольшее их количество образуется между разными типами цепей (a - b, α – δ, α - γ). Это преимущественно гидрофобные взаимодействия, которые возникают между радикалами некоторых аминокислот (лейцин, валин, фенилаланин и др.). Исследование структурной организации субъединиц молекулы гемоглобина в олигомерный белок проводилось с использованием раствора 8М мочевины или при резких изменениях рН. При этом молекула гемоглобина обратимо диссоциирует на две α- и две β-цепи. Эта диссоциация обусловлена разрывом водородных связей. После удаления мочевины происходит автоматическая ассоциация исходной молекулы гемоглобина (рис.2)
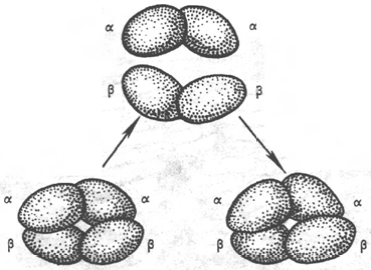
Рис. 2. Обратимая диссоциация молекулы гемоглобина при действии 8М раствора мочевины.
Небелковый компонент гемоглобина – гем. Основой структуры гема является протопорфирин. Протопорфирин состоит из четырех пиррольных колец, соединенных между собой α-метиновыми мостиками (–СН=). В зависимости от природы групп, которые находятся в боковых радикалах, порфирины имеют большое количество изомеров. Из возможных 15 изомеров протопорфиринов наиболее широко распространенным в биологических объектах является протопорфирин IX. Он содержит в боковых положениях 4 метильные, 2 винильные и 2 пропионильные группы (рис. 3 А). Хелатный комплекс протопорфирина IX с Fe2+ называется протогемом IX или гемом.
Катион железа, входящий в структуру гема, образует две ковалентные связи и две координационные связи с атомами азота пиррольных колец в плоскости протопорфиринового комплекса. Кроме этого, он участвует в образовании ещё двух координационных связей, которые расположены перпендикулярно плоскости протопорфиринового комплекса (рис. 3 Б).
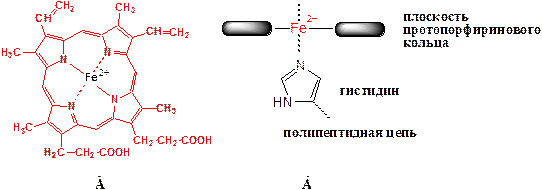
Рис. 3. Связи катиона железа в геме гемоглобина. А - вид сверху; Б - вид сбоку (координационная связь над плоскостью протопорфиринового кольца свободна).
Пятая координационная связь атома железа обеспечивает присоединение гема к остатку гистидина, который находится в полипептидной цепи глобина.
Шестая координационная связь катиона железа используется для присоединения к гему различных лигандов (молекулы кислорода, монооксида углерода или других соединений). Именно данная связь имеет специальное значение для обратимого связывания молекулы кислорода.
Дата добавления: 2016-03-05; просмотров: 6504;
