Ферменты-гемопротеины
Кроме цитохромов, гемоглобина и миоглобина к гемопротеинам относят также широко распространенные в животных и растительных организмах ферменты каталазу и пероксидазы, защищающие клетки тканей от повреждающего действия пероксида водорода (перекиси водорода).
Каталаза представляет собой один из наиболее активных ферментов, содержащихся в специальных внутриклеточных структурах - пероксисомах. Наибольшая активность этого фермента проявляется в эритроцитах крови.
Пероксидазы, в отличие от каталазы, кроме пероксида водорода катализируют распад органических пероксидов. Они широко распространены в различных внутриклеточных компартментах, в том числе, в митохондриях и цитозоле.
Завершая рассмотрение гемопротеинов, следует отметить их общее свойство - все они имеют характерный максимум поглощения света в видимой области спектра. За счет этого их растворы приобретают также характерную окраску.
Флавопротеины
Данные сложные белки имеют молекулы, в состав которых в качестве простетической группы входит производное рибофлавина - витамина В2. Рибофлавин состоит из трехцикличного соединения изоалоксазина и спирта рибитола, откуда и происходит его название (рис. 12).
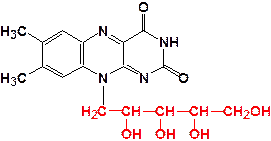
Рис. 12. Строение молекулы рибофлавина
Флавиновая простетическая группа может быть представлена в виде ФАД (флавинадениндинуклеотида) или ФМН (флавинмононуклеотида). С помощью ковалентных связей она присоединяется к полипептидной цепи белка. Остаток рибофлавина в составе простетической группы флавиновых дегидрогеназ имеет свойство акцептировать и отдавать ионы водорода и электроны. По этой причине флавиновые дегидрогеназы участвуют во многих окислительно-восстановительных процессах в клетке. Все флавиновые коферменты в окисленной форме окрашены в желто-оранжевый цвет и имеют характерные полосы поглощения с максимумом в области 370 и 450нм.
Большое количество флавиновых дегидрогеназ является мембраносвязывающими белками. Они принимают участие в транспорте электронов по дыхательной цепи митохондрий и электронотранспортной цепи эндоплазматического ретикулума (НАДН-дегидрогеназа, сукцинатдегидрогеназа, НАДФН-зависимый флавопротеин микросомальной оксигеназной цепи и др.).
Следует отметить, что флавопротеины представляют собой очень сложно построенные молекулы белков. Кроме флавиновой группы, они содержат и другие небелковые компоненты. Так, в структуру сукцинатдегидрогеназы дополнительно входят еще три FeS-центра и гем типа b. На рис. 13 представлена структура молекулы сукцинатдегидрогеназы. Наряду с мембранозвязывающими встречаются также и растворимые флавиновые дегидрогеназы. Они локализуются в цитоплазме клеток. К ним относится широко распространенный фермент ксантиноксидаза, которая содержит ион молибдена, входящий в состав молибденоптерина.
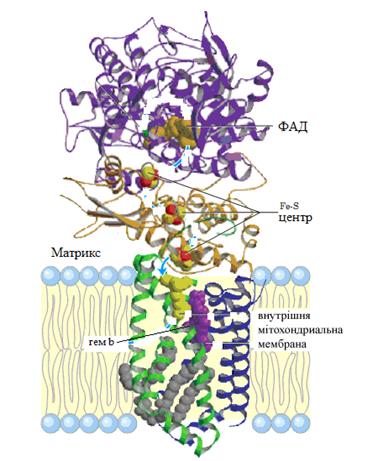
Рис. 13. Сукцинатдегидрогеназа митохондрий.
Молекула сукцинатдегидрогеназы состоит из четырех субъединиц: две встроены во внутреннюю митохондриальную мембрану и две обращены к митохондриальному матриксу. В качестве небелковых компонентов в молекулу входят : флавиновая простетическая группа – ФАД, 3 FeS- центра и гем типа b (Nelson D.L., Cox M.M., 2004)
Ретинальпротеины
Родопсины – сложные белки, в которых апопротеин (опсин) связан с простетической группой, которая представлена цис-изомером ретиналя (альдегидной формой витамина А) (рис. 14 та 15):
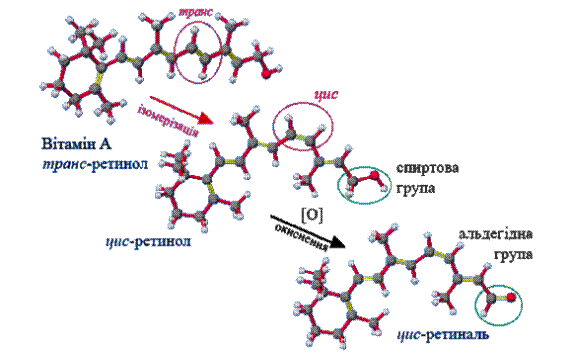
Рис. 14. Образование 11-цис-ретиналя из витамина А
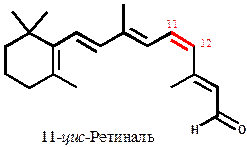
Рис. 15. Структура 11-цис-ретиналя
Простетическая группа присоединяется к остатку лизина полипептидной цепи опсина, образуя при этом соединение типа основание Шиффа (рис. 16).
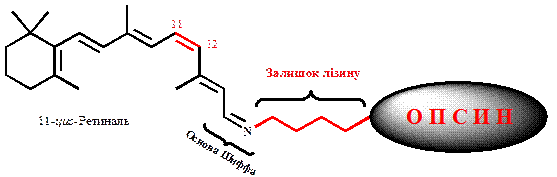
Рис.16 . Соединение 11-цис – ретиналя с лизиновым остатком опсина путем образования шиффовой основы.
Сетчатка глаза человека содержит рецепторные клетки двух типов - палочки и колбочки. Палочки отличаются большой светочувствительностью, предназначены для зрения при малой освещенности (обеспечивают сумеречное и ночное зрение), и дают черно-белую картинку. Колбочки обеспечивают цветное и дневное зрение.
В палочках молекула родопсина жестко встроена в мембрану диска фоточувствительных клеток сетчатки глаза. Полипептидная цепь опсина заключена таким образом, что она образует 7 спиральных фрагментов, которые насквозь пересекают мембрану. При этом остаток ретиналя оказывается в толще мембраны.
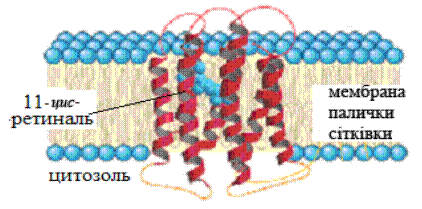
Рис.17. Расположение родопсина в мембране палочки сетчатки глаза. С центральной частью опсина в толще мембраны связан остаток 11-цис-ретиналя (Nelson D.L., Cox M.M., 2004)
Под влиянием кванта света видимого участка спектра происходит изомеризация 11-цис-ретиналя в транс-ретиналь. Шиффова основа лизина с данным изомером ретиналя существовать не может. Поэтому ретиналь распадается на свободный опсин и трас-ретиналь , что обуславливает его участие в процессе световосприятия. Родопсин окрашен в красный цвет , который ему придает цис-ретиналь. При освещении родопсин обесцвечивается , поскольку образовывается трас-ретиналь.
В специальных фоточувствительных клетках сетчатки глаза – колбочках, которые обеспечивают процесс цветного зрения, присутствуют 3 изомерные формы родопсина. Они являются продуктами экспрессии разных генов и поэтому отличаются друг от друга первичной структурой полипептидной цепи. Их характерным свойством является отличие в максимуме спектра поглощения компонентов невидимого света - синего, зеленого и красного (рис.18)
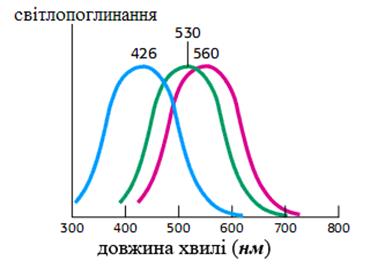
Рис. 18. Спектр поглощения трех разных изоформ родопсинов колбочек сетчатки глаза.
Отличия в максимуме спектра поглощения позволяют изомерным формам родопсина распадаться под влиянием кванта света с разной длинной волны, что и лежит в основе цветного световосприятия.
Глава 2. Обмен гемоглобина и его нарушения
Синтез гемоглобина
Синтез гемоглобина наиболее активно протекает в печени, красном костном мозге и осуществляется в два этапа. В одном из них происходит образование белкового компонента гемопротеина, а в другом – простетической группы - гема. Синтез белковой части происходит на рибосомах в цитоплазме гепатоцитов, при этом транслируются 2 альфа- и 2 бета-цепи, которые далее в пост-трансляционном процессинге присоединяют каждая по одному гему. Таким образом, происходит образование четырех субъединиц молекулы гемоглобина, которые потом объединяются в тетрамерную структуру.
Образование гема также происходит в гепатоцитах. Предшественниками его биосинтеза являются метаболит цикла трикарбоновых кислот – сукцинил-КоА, а также заменимая аминокислота глицин.
Образование гема в гепатоцитах представляет собой сложный многоступенчатый процесс, подверженный тонким механизмам регуляции, который состоит из четырех отдельных стадий:
1. синтез дельта - аминолевулиновой кислоты;
2. образование порфобилиногена;
3. синтез протопорфирина IХ;
4. образование гема.
В первой стадии процесса, происходящей в митохондриях гепатоцитов, из сукцинил-КоА и глицина образуется дельта-аминолевулиновая кислота. Реакцию катализирует фермент дельта-аминолевулинатсинтаза (АЛС). АЛС является пиридоксаль-зависимым ферментом. Активность данного фермента лимитирует скорость течения всего процесса, поэтому данная реакция является главной по регуляции синтеза гема:
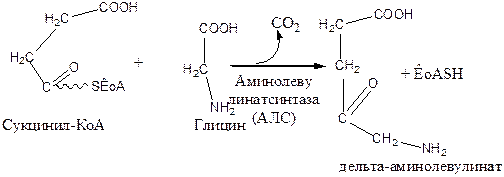
Продукт реакции транспортируется из митохондрий в цитозоль гепатоцита. Здесь, под влиянием порфобилиногенсинтазы из 2 молекул дельта-аминолевулиновой кислоты синтезируется молекула порфобилиногена: 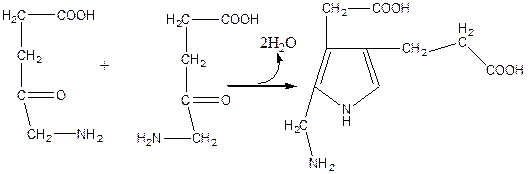
На следующей стадии синтеза гема четыре молекулы порфобилиногена используются для образования линейного тетрапиррольного промежуточного продукта гидроксиметилбилана (* - фермент уропорфириноген синтаза I). Затем следующий фермент уропорфириноген косинтаза III (**) заканчивает превращение:
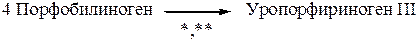
Генетический дефект уропорфириноген синтазы I у больных сопровождается интенсивным накоплением дельта-аминолевулиновой кислоты и порфобилиногена в плазме крови, что приводит к развитию клинических симптомов острой перемежающейся порфирии Acute intermittent porphyria (см. ниже).
Генетический дефект фермента уропорфириноген косинтазы III (конгенитальная эритропоэтическая порфирия, Congenital erythropoetic porphyria) сопровождается у больных интенсивной экскрецией с мочой уропорфириногена I. Патология имеет ряд специальных клинических симптомов, главные из которых дерматиты и тяжелая форма гемолитической анемии.
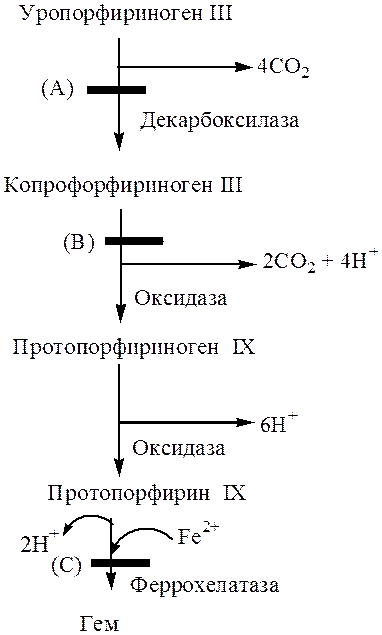
Схема 1. Превращение уропорфобилиногена III в гем.
Следующие четыре превращения имеют решающее значение для образования гема. Ферменты этих реакций могут также быть в дефиците у больных с генетическими нарушениями их синтеза. Повышенная фоточувствительность и дерматологические проблемы наблюдаются у больных с дефицитом декарбоксилазы (схема 1, А- Порфирия cutanea tarda).
Копропорфирия развивается у больных с генетическим нарушением фермента копропорфириноген оксидазы III (схема 1, В). У пациентов наблюдаются нейрологические проблемы и повышенная фоточувствительность.
Нарушение (схема 1, C) синтеза феррохелатазы у больных носит название протопорфирия, при этом наблюдается повышенное депонирование железа в тканях больного с появлением дерматологических проблем и анемии.
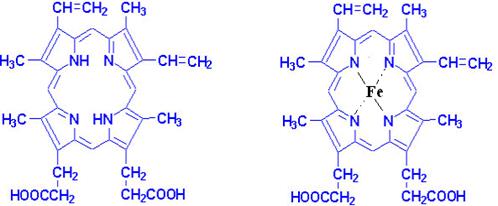
(А) (В)
Рис.11. Структура протопорфирина IX (А) и гема (В).
Источником железа для синтеза гема в печени является белок ферритин. Он представляет собой довольно крупную по массе белковую молекулу, в структуре которой существует большая внутренняя полость. Внутри нее может аккумулироваться до 4500 катионов железа.
Катионы железа поступают в гепатоциты из кишечника. Их транспорт в крови обеспечивается белком бета-глобулиновой фракции крови – трансферрином. Трансферрин представляет собой белок с небольшой молекулярной массой, на котором имеется 2 участка связывания атомов железа (Fe+3). Полипептидная цепь этого белка (апотрансферрин) синтезируется в гепатоцитах. На мембранах гепатоцитов имеются особые рецепторы, которые обладают способностью специфически связывать трансферрин крови. В результате связывания, он в комплексе с рецептором, путем эндоцитоза попадает внутрь клетки. Здесь освобождается связанное и ним железо, которое включается в ферритин. В свою очередь, освободившийся от атомов железа апоферритин, вновь выделяется из клетки печени в кровь, связывается с другими атомами железа и транспортирует их в печень.
В гепатоцитах образуются различные типы гема, которые могут использоваться не только для синтеза гемоглобина, но и синтеза цитохромов, выполняющих функцию переносчиков электронов в дыхательной цепи митохондрий (цитохромы типа b, c и a) и оксигеназной микросомальной ред-окс цепи (цитохром Р450). В этой связи, значение данного биосинтеза в печени не ограничивается его ролью в образовании небелковой части гемоглобина. Синтез гема имеет непосредственное отношение к энергетическому обеспечению гепатоцитов, а также к процессам модификации чужеродных и эндогенных токсичных соединений, попадающих в гепатоцит. Нарушение синтеза гема в печени будет сопровождать нарушения синтеза и биотрансформации стероидов, так как цитохром Р450-содержащие мультиферментные системы участвуют в данных метаболических путях и требуют наличия данной небелковой части.

Схема 2. Регуляция ключевого фермента синтеза гема дельта-аминолевулинатсинтазы.
Процесс биосинтеза гема подвержен тонкому механизму регуляции. Дельта-аминолевулинатсинтаза является аллостерическим энзимом, который ингибируется по принципу отрицательной обратной связи конечным продуктом процесса – гемом. Активность данного фермента снижается при нагрузке глюкозой и гематином - продуктом распада пищевого гемоглобина. Все положительные эффекторы фермента указаны в схеме 2.
Дата добавления: 2016-03-05; просмотров: 3906;
