ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА.
План
1. Работа гальванического элемента (ГЭ).
2. Применение ГЭ. Перспективы развития.
2.1 кислотные аккумуляторы;
2.2 щелочные аккумуляторы;
2.3 топливные элементы.
Литература
1. Фролов В.В. Химия. Гл.V, §51-56.
2. Ахметов Н.С. Общая и неорганическая химия. Раздел V, гл.3,4.
3. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.
Химические источники тока (ХИТ) - это гальванические элементы, аккумуляторы и топливные элементы (ТЭ). Их используют как автономные малогабаритные источники энергии для транспортных двигателей и машин, радиотехнических устройств, приборов управления, освещения и т.д. К достоинствам современных ХИТ можно отнести относительно высокие КПД и удельную мощность. Это позволяет им конкурировать с другими видами источников энергии.
Чтобы создавать и правильно использовать ХИТ, необходимо знать закономерности протекания электрохимических процессов, в основе которых лежат реакции ОВР.
Гальваническими элементами (ГЭ)называются устройства, преобразующие энергию ОВР в электрическую. Они обычно состоят из двух электродов (анода и катода), изготовленных из различных металлов или их соединений, погруженных в электролиты (растворы солей этих металлов, растворы кислот, щелочей, токопроводящие пасты).
Анод (А)– это электрод, на котором происходит процесс окисленияили отдачи электронов.
Катод (К)- это электрод, на котором происходит процесс восстановленияили принятия электронов.
Элемент Даниэля-Якоби является одним из самых простых и распространенных гальванических элементов. Он состоит из цинкового и медного электродов, погруженных соответственно в растворы сульфата цинка и сульфата меди. Растворы солей разделены пористой полупроницаемой перегородкой или соединены электролитическим мостиком
1 стадия работы ГЭ:растворение (окисление) электрода, изготовленного из более активного металла (анода)
Zn0 + nH2O - 2ē → Zn2+·nH2O
Zn0 - 2ē → Zn2+
2 стадия – это прохождение электрического тока (направленный поток ē) по металлическому проводнику. Если цинк и медь соединить проводником, то электроны будут перемещаться от цинкового анода ( А-) к медному катоду ( К+).
3 стадия-на поверхности катода произойдет разрядка (восстановление) ионов Сu2+:
Cu2+·nH2O + 2ē → Cu0 + nH2O
Cu2+ + 2ē → Cu0.
Чтобы ГЭ работал, необходимо, чтобы две изолированные системы были соединены электролитическим мостиком (агар-агар+KCl) или полупроницаемой перегородкой, по которым от К+ к А- будут перемещаться ионы SO42-. Все стадии процессов,протекающих в ГЭ, связаны между собой и идут с одинаковой скоростью.
Схема работы гальванического элемента.
(-) (+)
(А) Zn │ ZnSO4 ││CuSO4 │Cu (K)
если[Zn2+]=[Cu2+]=1моль/л

Анодный процесс: Zn0 - 2ē → Zn2+ E0A= -0,76 (B)
Kатодный процесс: Cu2+ + 2ē → Cu0 E0K= +0,34 (B)

Ионное уравнение: Zn + Cu2+ → Zn2+ + Cu0
SO42- SO42-

Молекулярное уравнение: Zn + CuSO4 → ZnSO4 + Cu ЭДС=Е0-ЕВ=ЕК-ЕА=0.34-(-0.76)=1.18 (В).
В гальванической паре анодом (А-) всегда будет электрод с меньшим значением электродного потенциала (Е), а катодом (К+) – электрод с большим значением Е.
Работа по переносу электронов во внешней цепи и ионов во внутренней цепи в ГЭ равна произведению перенесенного заряда (n.F) на разность потенциалов (ΔE). Максимальное значение работы (Амах) достигается, когда ГЭ работает обратимо. В этом случае Амах=n.F. ΔE. Для станадартных условий Амах для элемента Даниеля-Якоби составляет:
Амах=n.F. ΔE=2.96500.1,1=212,46 кДж
Максимально полезная работа, которую может совершить система при протекании реакции в условиях постоянного давления и температуры, равна убыли энергии Гиббса (более подробно этот вопрс рассматривается в лекции по термодинамике).
Амах=ΔG0298
ΔG = -nFΔE,
где n – число электронов, участвующих в процессе;
F – число Фарадея;
ΔЕ – ЭДС.
Это уравнение устанавливает связь между химической и электрической энергиями. ЭДС ГЭ подобно ΔG может служить критерием равновесия и возможности самопроизвольного протекания окислительно-восстановительных реакций в определенном направлении: при этом условии – самопроизвольное протекание процесса (ΔG<0) соответствует условию ΔЕ>0. Критерием равновесия (ΔG=0) является равенство ЭДС ГЭ нулю.
С учетом последнего уравнение Нернста приобретает вид:
ЭДС= ΔЕ= (RT/n.F).lnKР,
Где КР- термодинамическая константа равновесия токообразующей реакции. Это выражение позволяет рассчитывать константу равновесия КР любой токообразующей ОВР.
Задача. Будет ли работать ГЭ, состоящий из никелевого электрода, погруженного в раствор NiSO4 с концентрацией 0,01 моль/л и стандартного железного электрода? Составьте схему, напишите уравнения электродных процессов, рассчитайте ЭДС и ΔG0298 элемента и сделайте вывод о возможности его работы.
Решение. Определяем потенциал электродов. Для стандартного железного электрода потенциал находим в ряду напряжений металлов. 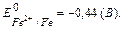 Для никелевого электрода вычисляем потенциал по уравнению Нернста.
Для никелевого электрода вычисляем потенциал по уравнению Нернста.
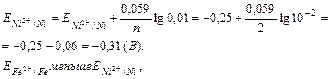
следовательно в ГЭ анодом является железо, а катодом - никель.
Запишем схему ГЭ:
(-) (+)
(А) Fe │ FeSO4 ││ NiSO4 │ Ni (K)
-0,44(В) 1моль/л 10-2 моль/л -0,31(В)
Запишем уравнения электродных процессов:
 А: Fe0 - 2ē → Fe2+ окисление ЕА=-0,44 (В)
А: Fe0 - 2ē → Fe2+ окисление ЕА=-0,44 (В)
K: Ni2+ + 2ē → Ni0 восстановление ЕК=-0,31 (В)

Fe + Ni2+ → Fe2+ + Ni0
 SO42- SO42-
SO42- SO42-
Fe + NiSO4 → FeSO4 + Ni
ЭДС=Е0-ЕВ=-0,31+0,44=0,13(В)
Для вычисления изменения энергии Гиббса воспользуемся формулой:
ΔG = -nFΔE= -2∙96500∙0,13 = -25090 Дж = -25,09 КДж, ΔG<0.
Этот ГЭ будет работать, хотя и имеет малую ЭДС.
Аккумуляторы– это химические источники тока многократного действия, их можно регенерировать, пропуская через них постоянный электрический ток.
Свинцовые аккумуляторы (кислотные) изготавливают из свинцовых пластин, на которые нанесен оксид свинца (PbO).
А Pb│ H2SO4│PbO К
Когда аккумулятор заливают серной кислотой, идет реакция:
PbO + H2SO4 → PbSO4 + H2O
Далее аккумулятор заряжают от внешнего источника постоянного тока.
 Зарядка (электролиз)
Зарядка (электролиз)
 К - Pb2+SO4 + 2ē → Pb0 + SO42- (на К- восстановление)
К - Pb2+SO4 + 2ē → Pb0 + SO42- (на К- восстановление)
+
A + Pb2+SO4 - 2ē + 2H2O → Pb+4O2 + SO42- + 4H+(на А+ окисление)

2PbSO4 + 2H2O → Pb + PbO2 + 2H2SO4
Заряженный аккумулятор можно сразу использовать по назначению. При хранении из аккумулятора надо вылить электролит, промыть водой и хранить до двух лет. Для дальнейшего использования надо залить электролит.
Разрядка.При разрядке анод и катод меняются местами.
Идут следующие реакции:
 А- Pb0 + SO42- - 2ē → PbSO4 1 +
А- Pb0 + SO42- - 2ē → PbSO4 1 +
К+ PbO2 + 2ē + SO42- + 4H+ → PbSO4 + 2Н2О 1

Pb + 2H2SO4 + PbO2 → 2PbSO4 + 2H2O
ЭДС=2,1 В.
Для промывки аккумулятора готовят раствор, в котором на 1 л 5% NH4OH берут 75 мл 2% трилона Б.
Преимущества свинцового аккумулятора:
1) большая электрическая емкость;
2) устойчивость в работе;
3) большое количество циклов зарядка-разрядка.
Недостатки:
1) большая масса;
2) выделение водорода при зарядке;
3) не герметичность при наличии концентрированного раствора серной кислоты.
Кадмиево-никелевые аккумуляторы (щелочные)
В основе их работы лежит химическая реакция:
 ЭДС = 1,4 В
ЭДС = 1,4 В
В аккумулятор заливают щелочной электролит, который готовят следующим образом : на 0,5 л воды берут 130 г КОН и 10 г LiOH . При зарядке идут следующие процессы:
 К - Cd2+(OH)2 + 2ē → Cd0 + 2OH- 1
К - Cd2+(OH)2 + 2ē → Cd0 + 2OH- 1
A+ 2Ni2+(OH)2 + 2OH - 2ē → 2Ni+3OOH- + 2H2O 1
 Cd2+(OH)2 + 2Ni+2(OH)2
Cd2+(OH)2 + 2Ni+2(OH)2  Cd0 + 2Ni+3OOH +2H2O
Cd0 + 2Ni+3OOH +2H2O
При разрядке:
А- Cd0 - 2ē + 2OH- → Cd(OH)2
K+ Ni2+3O3∙H2O → 2Ni+3OOH + 2H2O + 2ē → 2Ni(OH)2+ 2OH-

разрядка
 Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2
Cd + 2NiOOH + 2H2O Cd(OH)2 + 2Ni(OH)2
 зарядка
зарядка
В принципе, электрическую энергию может дать любая ОВР. Однако, число реакций, практически используемых в химических источниках электрического тока, невелико. Это связано с тем, что не всякая ОВР позволяет создать гальванический элемент, обладающий технически ценными свойствами (высокая и постоянная ЭДС, длительная сохранность и др.), кроме того, многие ОВР требуют расхода дорогостоящих веществ. В современных ГЭ (это устройства однократного действия) и аккумуляторах (устройства многократного действия) используют не 2, а 1 электролит. В качестве анода чаще всего используют цинк, а в качестве катода оксиды менее активных металлов. Все химические источники тока имеют два существенных недостатка:
1) высокую стоимость веществ (свинец, кадмий), из которых их изготавливают;
2) малое отношение количества энергии, которую дает элемент к его массе.
Работая над этой проблемой, пришли к созданию топливных элементов.
Дата добавления: 2016-02-27; просмотров: 1364;
