Окисление ионов на аноде: на аноде окисляются в первую очередь анионы с меньшим значением электродного потенциала.
Возможные анодные процессы при электролизе водных растворов:
- окисление молекул воды (рН < 7): 2Н2О - 4ē → О2 + 4Н+; Е0=+ 1,23 (В)
- окисление ОН 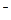 ионов (рН ≥ 7) : 4ОН- - 4ē → О2 + 2Н2О;Е0=+ 0,40 (В)
ионов (рН ≥ 7) : 4ОН- - 4ē → О2 + 2Н2О;Е0=+ 0,40 (В)
- анионы кислот по отношению к электроокислению делят на 2 группы:
а) анионы кислород не содержащих кислот (Cl-, Br-, I-, S2-) легко окисляются: 2I- 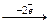 I2; E0 = +0,54 (B);
I2; E0 = +0,54 (B);
б) анионы кислород содержащих кислот (SO42-, NO3-, CO32-, PO43-) удерживают электроны прочнее, чем молекулы воды, поэтому на аноде окисляется вода по приведенной выше схеме.
- растворение анода:. M0 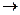 М+n +n ē
М+n +n ē
Различают растворимые электроды (Cu;Zn и т.д.) и инертныеэлектроды (C; Au; Pt).
Рассмотрим пример электролиза раствора хлорида меди (ll) с растворимым медным анодом:
CuCl2 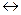 Cu2+ + 2Cl-
Cu2+ + 2Cl-
К - Cu2+ (E0 = + 0,34 В) А+(Cu) Cl-( E0 = +1,36 B)
H2O (E0 = - 0,83 В) H2O (E0 = +1,23) 
Cu0 (E0 = + 0,34 )
восстанавливаетсяся частица окисляется частица с
с большим потенциалом меньшим потенциалом.
Cu2+  Cu0 Cu0
Cu0 Cu0  Cu2+
Cu2+
Этот способ используют для электролитического рафинирования металлов (очистка) в промышленных условиях.
Для того, чтобы произошла разрядка ионов на электродах, к ним надо приложить определенную электродвижущую силу, равную разности потенциалов, называемую потенциалом разложения (Е0разл.), который численно равен по модулю электродвижущей силе гальванического элемента, составленного на основе продуктов электролиза. Например:
рассчитать потенциал разложения 1М соляной кислоты.
HCl ↔ H+ + Cl-
окислитель К- 2Н+ + 2ē → Н2 восстановление
восстановительА+ 2Cl- - 2ē → Cl2 окисление.
ЭДС = ЕК0 – ЕА0 = 0 – 1,36 =│1,36│В.
Последовательность разрядки ионов при электролизе может нарушаться из-за явления называемого перенапряжением. Перенапряжение равно разности между напряжением положенным на электроды и ЭДС гальванического элемента, отвечающего обратной реакции. Поэтому, делая расчеты реальных электрохимических процессов, необходимо помнить, что реальная разность потенциалов при электролизе (ΔЕ) слагается из: потенциала разложения (Еразл.), ЭДС для преодоления сопротивления электролита, суммы катодного и анодного перенапряжения, которые обусловлены побочными процессами, происходящими на электродах, такими как:
- подход иона к электроду;
- потеря ионом гидратной оболочки (в растворе);
- разрядка иона;
- рекомбинация атомов в молекулы;
- отход молекулы от электрода.
ΔЕразл. = Еразл. + IR + ΔЕполяриз. + ΔЕконтакт.,,
где I – сила тока при электролизе;
R – сопротивление систем;
ΔЕполяриз. – разность потенциалов поляризации, препятствующая прохождению тока;
ΔЕконт. – сумма контактных потенциалов.
R – общее сопротивление системы, равное сумме сопротивлений электролита, диафрагмы электролизера и токоподводов к электролизеру.
Опыт показывает, что потенциалы выделения Е0(Men+) примерно равны их электродным потенциалам, а Е0выделения газов значительно больше их электродных потенциалов. Это объясняется так называемой газовой поляризацией, т.е. образованием на электродах «газовой шубы» за счет выделения водорода на катоде, а кислорода на аноде, или других газов. Газовая поляризация может остановить процессы, протекающие при электролизе, из-за изоляции электродов. Её негативное влияние может быть устранено добавлением окислителей водорода:K2Cr2O7, KMnO4  и восстановителей кислорода Na2SO3, Na3PO4
и восстановителей кислорода Na2SO3, Na3PO4  .
.
Кроме газовой поляризации, различают:
- концентрационную – за счет изменения концентрации в
приповерхностном слое электрода, если анод медный, то [Cu2+] у анода больше, чем у катода. Для устранения такой поляризации, необходимо перемешивать электролит;
- химическую– возникает вследствие того, что выделение продуктов
электролиза приводит к образованию гальванической цепи (идет обратная электролизу реакция).
Количественные соотношения при электролизе установлены в 1827г английским физиком Майклом Фарадеем.
Законы Фарадея:
Дата добавления: 2016-02-27; просмотров: 799;
