Зависимость скорости химической реакции от катализатора.
Катализатор – это вещество, изменяющее скорость химической реакции, количество которого в результате реакции остается неизменным. Изменение скорости химической реакции в присутствии катализаторов называется катализом. Реакции, скорость которых можно изменить при помощи катализаторов, называются каталитическими.Катализаторы, замедляющие скорость химической реакции, называются ингибиторами. Например, тетраэтилсвинец Pb(C2H5)4 – противодействует детонации топлива в двигателях внутреннего сгорания. Вещества, усиливающие действие катализатора называются промоторами. Вещества, подавляющие действие катализатора называются каталитическими ядами; биологические катализаторы называются ферментами.
Механизм катализа может быть различным. По теории промежуточных соединений катализатор (К) с одним из реагирующих веществ (А) образует промежуточное соединение АК ( активированный комплекс ) с более низким значением энергии активации, способное к более эффективному взаимодействию с другим веществом (В).
А + В 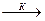 АВ
АВ
А + К 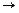 АК
АК
АК + В 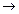 АВ + К
АВ + К
Таким образом, катализатор разбивает реакцию на промежуточные стадии; при этом образуется ряд неустойчивых промежуточных соединений – активированных комплексов. Например, самопроизвольный процесс разложения пероксида водорода идет медленно: Н2О2 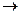 Н2О + 1/2О2 Еа = 75 кДж/моль .Использование катализатора MnO2 увеличивает скорость реакции (Еа = 49 кДж/моль ), за счет образования активированного комплекса MnO3 :
Н2О + 1/2О2 Еа = 75 кДж/моль .Использование катализатора MnO2 увеличивает скорость реакции (Еа = 49 кДж/моль ), за счет образования активированного комплекса MnO3 :
Н2О2 + MnO2 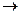 H2O + MnO3
H2O + MnO3
 MnO3
MnO3 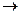 MnO2+ 1/2O2 H2O2 + MnO2
MnO2+ 1/2O2 H2O2 + MnO2 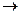 H2O + MnO2 + 1/2O2
H2O + MnO2 + 1/2O2
Катализатор снижает энергию активации, разбивая реакцию на ряд промежуточных стадий.
Катализатор может быть специфичен для однотипных реакций, например, V2O5 ускоряет реакции окисления SO2, NH3 и т.д. Он может быть и универсален, т.е. может изменять скорости разных реакций, например,
2SO2 + O2 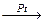 2SO3; CH2 = CH2 + H2
2SO3; CH2 = CH2 + H2  CH3 – CH3. Катализатор может изменять не только скорость химической реакции, но и ее механизм.
CH3 – CH3. Катализатор может изменять не только скорость химической реакции, но и ее механизм.
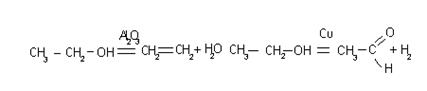
Дата добавления: 2016-02-27; просмотров: 992;
