Зависимость скорости химической реакции от природы реагирующих веществ.
Говорить о скорости химической реакции имеет смысл, если природа реагирующих веществ позволяет им вступать в химическое взаимодействие. Например, природа реагирующих веществ позволяет протекать первой и второй реакции, но не позволяет третьей.
1. Mg + O2 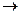 2MgО
2MgО
2. Zn + 2HCl 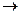 ZnCl2 + H2↑
ZnCl2 + H2↑
3. NaOH + KOH ≠ 
2. Зависимость скорости химической реакции от концентрацииреагирующих веществ определяется законом действия масс, который был установлен в 1867г опытным путем Гульдбергом и Вааге.
Скорость химической реакции при данной температуре пропорциональна произведению концентраций реагирующих веществ в степени, равной стехиометрическому коэффициенту, стоящему перед формулой данного вещества в уравнении реакции.
Закон действия масс справедлив только для наиболее простых по своему механизму реакций взаимодействия, протекающих в газах или в разбавленных растворах.
Для гомогенных реакций:
1.aA(Ж) + bB(Ж) ↔ cC(Ж) + dD(Ж) ; 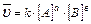 (T=const)
(T=const)
2. 3H2(Г) + N2(Г) ↔ 2NH3(Г); 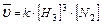
Для гетерогенных реакций:
1. aA(т) + bB(Г) = cC(Г) + dD(Г); 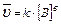 2. С (т)+О2(Г)=СО2(Г);
2. С (т)+О2(Г)=СО2(Г); 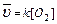
В законе действия масс не учитываются концентрации веществ, находящихся в твердой фазе. Чем больше площадь поверхности твердой фазы, тем выше скорость химической реакции.
k – константа скорости химической реакции определяется природой реагирующих веществ и зависит от температуры, от присутствия в системе катализатора, но не зависит от концентрации реагирующих веществ. Константа скорости представляет собой скорость химической реакции ( 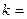
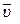 ), если концентрации реагирующих веществ
), если концентрации реагирующих веществ 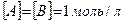 .
.
3. Зависимость скорости химической реакции от давления. Для газообразных систем увеличение давления или уменьшение объема, равноценно увеличению концентрации и наоборот.
Задача:Как изменится скорость химической реакции 2SO2(г) + O2(г) 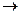 2SO3(г), если давление в системе увеличить в 4 раза?
2SO3(г), если давление в системе увеличить в 4 раза?
В соответствие с законом действия масс для прямой реакции, записываем выражение:
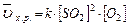 , пусть [SO2]=a моль/л, [O2]=b моль/л, тогда по закону действия масс
, пусть [SO2]=a моль/л, [O2]=b моль/л, тогда по закону действия масс 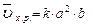
Уменьшение объема в 4 раза соответствует увеличению концентрации в системе в 4 раза, тогда
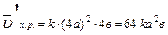 ;
;
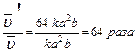 .
.
Дата добавления: 2016-02-27; просмотров: 1265;
