Зависимость скорости химической реакции от температуры.
Влияние температуры на скорость химической реакции приближенно определяется правилом Вант-Гоффа. При повышении температуры на 100С скорость химической реакции возрастает в 2-4раза.
Математическая запись правила Вант-Гоффа: 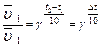 γ - температурный коэффициент скорости реакции или коэффициент Вант-Гоффадля большинства реакцийлежит в пределах 2-4.
γ - температурный коэффициент скорости реакции или коэффициент Вант-Гоффадля большинства реакцийлежит в пределах 2-4.
Задача. Во сколько раз изменится скорость химической реакции, протекающей в газовой фазе, если температура изменилась от 80 0С до 120 0С (γ = 3)?
В соответствии с правилом Вант-Гоффа записываем:
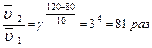
Увеличение скорости химической реакции при повышении температуры объясняется не только увеличением кинетической энергии взаимодействующих молекул. Например, число столкновений молекул растет пропорционально корню квадратному из абсолютной температуры 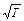 . При нагревании веществ от нуля до ста градусов по Цельсию, скорость движения молекул возрастает в 1,2 раза
. При нагревании веществ от нуля до ста градусов по Цельсию, скорость движения молекул возрастает в 1,2 раза 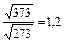 , а скорость химической реакции возрастает примерно в 59 тысяч раз. Такое резкое увеличение скорости реакции с ростом температуры объясняется долей активных молекул, столкновения которых приводит к химическому взаимодействию. Согласно теории активных столкновений в реакцию вступают только активные молекулы, энергия которых превышает среднюю энергию молекул данного вещества, т.е. молекулы, обладающие энергией активации.
, а скорость химической реакции возрастает примерно в 59 тысяч раз. Такое резкое увеличение скорости реакции с ростом температуры объясняется долей активных молекул, столкновения которых приводит к химическому взаимодействию. Согласно теории активных столкновений в реакцию вступают только активные молекулы, энергия которых превышает среднюю энергию молекул данного вещества, т.е. молекулы, обладающие энергией активации.
Энергия активации (EА)– это тот избыток энергии по сравнению со средним запасом, которым должны обладать молекулы для осуществления химической реакции. Если ЕА< 40 кДж/моль – реакции протекают быстро, если ЕА > 120 кДж/моль – реакции не идут, если ЕА = 40-120 кДж/моль – реакции протекают в обычных условиях. Повышение температуры снижает энергию активации, делает вещества более реакционно-способными, скорость взаимодействия при этом увеличивается.
Более точную зависимость скорости химической реакции от температуры установил C.Аррениус: константа скорости реакции пропорциональна основанию натурального логарифма, возведенного в степень ( –ЕА/RT). 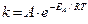 ,
,
А – предэкспоненциальный множитель, определяет число активных
соударений;
е – экспонента (основание натурального логарифма).
Логарифмируя выражение 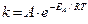 , получим уравнение:
, получим уравнение:
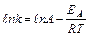 .Уравнение Аррениуса показывает, что скорость реакции тем выше, чем меньше энергия активации. Для снижения энергии активации используют катализаторы.
.Уравнение Аррениуса показывает, что скорость реакции тем выше, чем меньше энергия активации. Для снижения энергии активации используют катализаторы.
Дата добавления: 2016-02-27; просмотров: 1376;
