Термохимия – это раздел термодинамики, изучающий тепловые эффекты химических реакций.
Закон Гесса является основным законом термохимии (1840 г.):
Тепловой эффект химической реакции не зависит от механизма протекания реакции, а зависит лишь от природы и физического состояния исходных веществ и продуктов реакции (при условии V=const; P=const).
Проиллюстрируем данное утверждение на примере.
Димер оксида азота (IV) может быть получен несколькими способами.
Во-первых, 1) N2 + O2 = 2NO, DH1= 180900 Дж/моль;
2) 2NO + O2 = 2NO2, DH2= -77100 Дж/моль;
3) 2NO2 = N2O4, DH3=-10800 Дж/моль.
Или, во-вторых,
4) N2+ 2O2 = N2O4, DH4=93000 Дж/моль.
DH1 + DH2 + DH3 = DH4.
Более наглядно графическое выражение этих процессов:
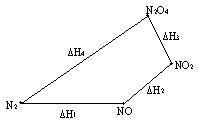
Рис.6
Поскольку в определение энтальпии входит внутренняя энергия, то абсолютное значение энтальпии системы (или какого-либо вещества) неизвестно. Поэтому энтальпию вещества характеризуют энтальпиями образования и сгорания.
DН0298(обр) (стандартная энтальпия образования) – это теплота реакции образования вещества (Х) из простых веществ (или элементов) при стандартных условиях: простые вещества ® Х.
Для простых веществ DН0обр равно нулю (в устойчивых агрегатных состояниях).
DН0сг (стандартная энтальпия сгорания) – теплота реакции сгорания вещества до оксидов (с максимальной степенью окисления) при стандартных условиях: Х + О2 ® оксиды (с максимальной степенью окисления).
Значения DН0обр и DН0сг содержатся в справочных таблицах.
Энтальпии многих реакций не поддаются экспериментальному определению, так как их проведение в лабораторных условиях невозможно. Например, в лабораторных условиях невозможно определить энтальпию образования этанола, так как его невозможно синтезировать из атомов С, Н, О. Энтальпии подобных реакций могут быть вычислены по известным энтальпиям других реакций с помощью одного из следствий закона Гесса.
Следствия из закона Гесса:
Тепловой эффект химической реакции может быть найден, как разность между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ, с учетом стехиометрических коэффициентов.
DНх.р. = SDН0 .298(обр) продуктов реакции – SDН0 298(обр) исходных веществ, с учетом стехиометрических коэффициентов.
Тепловой эффект химической реакции может быть найден, как разность между суммой теплот сгорания исходных веществ и суммой теплот сгорания продуктов реакции, с учетом стехиометрических коэффициентов.
DНх..р. = SDН0298(сгор) исходных веществ– SН0298(сгор) продуктов реакции с учетом стехиометрических коэффициентов.
S - греческая буква сигма, обозначающая математическую операцию суммирования.
Задача: Определить стандартную энтальпию образования DН0обр (РН3), исходя из уравнения.
2РН3(г) + 4О2(г) = Р2О5(к) + 3Н2О (ж), DНх.р = -2360 кДж.
Решение:
DНх. р. = [DН0обр (Р2О5(к)) +3DН0обр (Н2О (ж))] - 2DН0обр (РН3);
2DН0обр (РН3)= [DН0обр (Р2О5(к))+3DН0обр (Н2О (ж))] - DН0х. р.,
DН0обр (Р2О5(к)) = -1492 кДж/моль, DН0обр (Н2О (ж)) = -285,8 кДж/моль.
2DН0обр (РН3)= [(-1492 + 3(-285,8))] – (-2360)= 10.6 кДж/моль.
DН0обр (РН3)= 10,6/2=5,3 кДж/моль.
(т) - твердое агрегатное состояние, (ж)-жидкое агрегатное состояние, (г)- газообразное агрегатное состояние.
Не только химические, но и физико-химические процессы могут сопровождаться выделением или поглощением теплоты.
Растворение веществ.
Если вещество находится в твердом состоянии, то процесс можно представить в две стадии:
Вещество с кристаллической структурой 
DН0кр
молекулы  сольватированные молекулы
сольватированные молекулы
DН0сольв.
На первой стадии разрушается кристаллическая решетка, обычно это эндотермический процесс (DН0кр>0). На второй – происходит сольватация (гидратация, если растворитель вода) молекул вещества, это экзотермический процесс (DН0сольв<0). Результирующая теплота растворения DН0раств = DН0кр + DН0сольв может иметь как положительный, так и отрицательный знак.
При растворении газов отсутствует стадия разрушения кристаллической решетки. Остается экзотермическая сольватация. Поэтому растворение газов, как правило, экзотермично.
При растворении кристаллогидратов отсутствует стадия сольватации. Остается лишь эндотермическое разрушение кристаллической решетки. Процесс идет с поглощением теплоты.
В качестве примера рассмотрим:
1.Растворение безводной соли CuSO4 (т) сульфата меди:
CuSO4(т) ® CuSO4(ж)® CuSO4 . 5 H2O.
DН0кр = +11,7 кДж/моль; DН0сольв = -78,2 кДж/моль;
DН0раств = 11,7 – 78,2 = -66,5 кДж/моль
2.Растворение кристаллогидрата CuSO4 . 5 H2O
1. CuSO4 . 5 H2O (т) ® CuSO4 . 5 H2O (ж)
DН0раств = DН0кр = +11,7 кДж/моль.
Реакция нейтрализации.
Сильные кислоты и основания в растворе диссоциированы полностью, и поэтому теплота реакции нейтрализации (не зависимо от природы реагирующих веществ) одна и та же.
Рассчитаем ее:
Н+ (ж) + ОН- (ж) ® Н2О (ж)
DН0обр. кДж/моль 0 -230 -285.8
DН0нейтр. = -285.8 + 230 = -55.8 кДж/моль.
Если же в подобной реакции участвует слабый электролит, то процесс можно записать в две стадии:
ОН-
НА ® Н+ + А- ® А - + Н2О
DН0дис. DН0нейтр.
Первая стадия – это ионизация слабого электролита. Она обычно является эндотермической, когда для полной ионизации всех молекул слабого электролита требуется передать веществу теплоту. И чем слабее кислота, тем больше надо теплоты.
Итак, в реакции нейтрализации, идущей с участием слабого электролита, результирующее выделение энергии оказывается меньше, чем в случае сильного электролита.
Дата добавления: 2016-02-27; просмотров: 995;
