Последовательность заполнения атомных орбиталей, в зависимости от значений n и l, была сформулирована советским ученым
Клечковским.
1-е ПРАВИЛО КЛЕЧКОВСКОГО: При увеличении заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы (n+l) к орбиталям с большим значением этой суммы.
Например, атом калия, электронная формула которого 1s2 2s2 p6 3s2 p6 d 0 4s1 на третьем энергетическом уровне имеет только восемь электронов, из 18-ти возможных. Почему электрон заполняет 4s, а не 3d – подуровень? Рассчитавдля атома калия по правилу Клечковского сумму (n+l) для Зd(3+2=5) и 4s(4+0=4) подуровней, делаем вывод, что в первую очередь должен заполнятся 4s, а потом 3d-подуровень, в соответствии с первым правилом Клечковского.
2-е ПРАВИЛО КЛЕЧКОВСКОГО: Если у орбиталей сумма главного квантового числа и орбитального квантового числа (n+l) одинакова, то заполняется прежде орбиталь с меньшим значением главного квантового числа n.
При заполнении электронных орбиталей у атома скандия, электронная формула которого 1s22s2p63s2p6d14s2 , электрон заполняет 3d(3+2=5), а не 4р(4+1=5)-подуровень, в соответствии со вторым правилом Клечковского.
У некоторых атомов наблюдается явление «электронного проскока», как, например, у атома хрома: Cr 3d44s2→3d54s1 или у атома меди: Cu3d94s2→3d104s1.
Это объясняется повышенной энергетической устойчивостью электронных конфигураций с полностью (атом Сu) или наполовину заполненным подуровнем (атом Cr ).
ПЕРИОДИЧЕСКИЙ ЗАКОН Д.И.МЕНДЕЛЕЕВА.
ЗАКОНОМЕРНОСТИ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ.
План
1. Периодический закон Д.И.Менделеева.
2. Строение периодической системы Д.И.Менделеева.
3. Физический смысл величин периодической системы.
4. Закономерности периодической системы. Радиус атома. Валентность элемента.
5. Энергия ионизации, энергия сродства к электрону, электроотрицательность.
6. План характеристики свойств элементов по их положению в периодической системе.
Литература:
1. Фролов В.В. Химия. Гл.V, §51-56.
2. Лучинский Г.П. Курс химии. Гл.V, §8-12, гл. VI, §13-18
3. Ахметов Н.С. Общая и неорганическая химия. Раздел V, гл.3,4.
4. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.
Периодический закон был сформулирован 1 марта 1869 года великим русским ученым Дмитрием Ивановичем Менделеевым.
Периодический закон в интерпретации Д.И.Менделеева: свойства простых тел, а также формы и свойства их соединений находятся в периодической зависимости от величины атомных весов элементов.
Современная формулировка периодического закона: свойства простых тел, а также формы и свойства их соединений находятся в периодической зависимости от величины зарядов их атомных ядер.
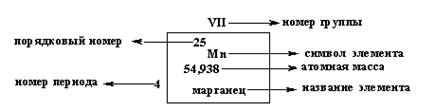
Периодическая система элементов является графическим изображением периодического закона. Известно несколько сотен форм периодической системы, однако, на Украине чаще используется короткопериодный вариант периодической системы. Периодическая система состоит из периодов и групп.
Период – это горизонтальный ряд элементов, расположенных в порядке возрастания порядкового номера от первого s-элемента (ns1) до р-элемента (ns2np6). Каждый период (кроме первого) начинается активным щелочным металлом и заканчивается инертным газом, перед которым стоит активный не металл (галоген). В периодах происходит заполнение электронами внешней (n) электронной оболочки атомов, а также незаполненных предвнешних (n-1) и (n-2) оболочек. Различают: малые (1,2,3) и большие (4,5,6,7) периоды. В периоде слева направо металлические свойства элементов убывают, а неметаллические – возрастают.
Номер периода указывает на число энергетических уровней (электронных оболочек) в атоме и совпадает со значением главного квантового числа (n) внешнего энергетического уровня.
Группы – это вертикальный ряд элементов, обладающих однотипным электронным строением. В соответствии с максимальным числом электронов на внешнем электронном слое невозбужденных атомов элементы периодической системы подразделяются на восемь групп. В группе выделяют главную (А) (в нее входят s- и р - элементы малых и больших периодов) и побочную (В) (в нее входят элементы только больших периодов) подгруппы.
Номер группы соответствует высшей валентности элемента.
Под валентностью химического элемента подразумевается его способность к образованию химических связей. В представлении метода валентных связей численное значение валентности соответствует количеству неспаренных электронов. В периодической системе каждый элемент имеет строго определенный порядковый номер и занимает строго определенное место.
Порядковый номер элемента соответствует положительному заряду ядра атома (количеству протонов - ∑ 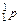 ) и общему количеству электронов (
) и общему количеству электронов (  ) на его орбиталях.
) на его орбиталях.
Валентные электроны обладают наибольшим запасом энергии, они определяют химические свойства атомов. Атомы, вступая в химические реакции, могут отдавать валентные электроны, принимать их или образовывать общие электронные пары.
Способность атомов отдавать или принимать электроны определяется радиусом атома (Rат) хотя эта величина физическая, в ней заключен глубокий химический смысл. Чем больше Rат, тем легче атом теряет свои валентные электроны и труднее их присоединяет.
В периоде Rат уменьшается слева направо, так как с увеличением порядкового номера элемента количество энергетических слоев или оболочек не меняется, а количество электронов на них и заряд ядра атома увеличиваются. Это приводит к сжатию электронной плотности и как следствие, уменьшению Rат.
В группе Rат увеличивается сверху вниз, так как с увеличением порядкового номера элемента, увеличивается количество оболочек и силы, связывающие электроны с положительно заряженным ядром атома ослабевают. Атомы, отдающие электроны, проявляют восстановительныесвойства.
Количественной характеристикой восстановительных свойств элементов являетсяэнергия ионизации (I , кДж/моль, эВ/атом).
Энергия ионизации – это количество энергии, необходимое для отрыва электрона от невозбужденного атома с превращением последнего в положительно заряженный ион (катион). Первая энергия ионизации характеризует способность атома отдавать один электрон: Э0 + I  Э+ + ē.
Э+ + ē.
Для многоэлектронных атомов энергии ионизации I1; I2; I3... соотвествуют отрыву первого, второго и т.д. электронов. При этом I1< I2 <I3..., т.к. увеличение числа оторванных электронов приводит к возрастанию положительного заряда образующегося иона.
Отношение энергии ионизации к заряду электрона называется потенциалом ионизации (измеряется в электрон-вольтах, (эВ)). Потенциал ионизации численно равен энергии ионизации.
В периоде значение энергии ионизации от щелочных металлов к инертным газам увеличивается, т.к. Rат уменьшается, а заряд ядра атома увеличивается в результате чего происходит сжатие электронной плотности, поэтому необходимо затрачивать большее количество энергии для отрыва электрона от нейтрального атома.
В группах за счет увеличения радиуса атома сверху вниз, энергия ионизации уменьшается.Самая малая энергия ионизации у франция 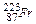 .
.
Атомы, принимающие электроны, проявляют окислительныесвойства. Количественной характеристикой окислительных свойств элемента является энергия сродства к электрону (Е; эВ/атом).
Энергия сродства к электрону – это энергия, выделяющаяся при присоединении электрона к нейтральному атому, она характеризует способность атома к образованию отрицательно заряженных ионов: Э0 + ē 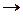 Э- + Е.
Э- + Е.
Наибольшее сродство к электрону у атома F. Энергия сродства к электрону значительно меньше энергии ионизации тех же атомов.
Обе эти величины (I и Е) зависят от заряда ядра и размеров атома: с увеличением заряда ядра они должны расти, а с увеличением радиуса атома – уменьшаться.
Для сравнительной оценки I и Е в 1932 году американским ученым Полингом введена особая характеристика – электроотрицательность (ЭО), которая определяется по Малликену, как способность атомов в молекуле притягивать электронную плотность.
ЭО = 1/2(I + Е).
Чем больше величина ЭО, тем сильнее выражены у элемента неметаллические свойства. Чем меньше величина ЭО, тем сильнее выражены - металлические свойства. Эта величина не имеет строго физического смысла, но удобна для оценки реального состояния химической связи в молекулах. За единицу ЭО принята ЭО лития. Самым электроотрицательным элементом является фтор.
С точки зрения строения атома все элементы можно разделить на четыре типа:
s - элементы (заполняется s- подуровень АО внешней оболочки): ...ns1, ns2
p - элементы (заполняется p -подуровень АО внешней оболочки) ... np1- np6.
d - элементы (заполняется d-подуровень АО незаполненной предвнешней оболочки) ... (n-1)d1ns2 – (n-1)d10ns1.
f - элементы (заполняется f-подуровень АО незаполненной третьей снаружи оболочки) ... (n-2)f1 ns2 - (n-2)f14 ns2.
Так как на s – подуровне может быть (1-2) е, то s-элементы располагаются в IА и IIА группах, главных подгруппах. Это типичные металлы, имеют сходные химические свойства,так как являются электронными аналогами.
Электронные аналоги – это элементы, у которых валентные электроны расположены на орбиталях, описываемых общей для всех электронной формулой:
Li Na K Pb Cs Fr
2s¹ 3s¹ 4s¹ 5s¹ 6s¹ 7s¹
ns1 – электронные аналоги
Таблица №5
| восстановитель | оксид | гидроксид основание | К-та | соль | |
| У атома 11Na 11 электронов, из них один валентный, поэтому Na металл В Внорм = 1 |
Na0 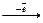 Na+ (о (окисляется) Na+ (о (окисляется)
| Na2O | NaOH | ---- | NaCl |
Be Mg Ca Sr Ba
2s2 3s2 4s2 5s2 6s2
ns² – электронные аналоги
Таблица №6
| восстановитель | Оксид | основание | кислота | соль | |
| 56Ba – металл Bнорм=0 B*(возб.сост.)=2 | Ba0 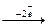 Ba2+
Ba2+
| BaO | Ba(OH)2 | ----- | BaSO4 |
На p – подуровне может быть (1-6) электронов, поэтому p – элементы располагаются в IIIA – VIIIA группах, главных подгруппах. Таким образом, главные подгруппы составляют только s- и p – элементы. Среди p–элементов могут быть металлы, но они чаще всего амфотерны:
Таблица №7
| восстановитель | оксид | основание | кислота | соль | |
| 13Al Внорм=1 В*=3 (наиб. устойч.) | Al0 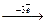 Al3+ Al3+
| Al2O3 | Al(OH)3 | НАlO2 Н3АlO3 | AlCl3 NaAlO2 Na3[Al(OH)6] |
p–элементы у которых (4-8) электронов на последнем энергетическом уровне являются неметаллами.
Таблица №8
| окислитель | оксид | основание | кислота | соль | |
| 9F | F0 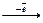 F -
(в-ся) F -
(в-ся)
| F2O | – | HF | NaF |
17Cl (проявляет переменную валентность за счет появления вакантного 3d – подуровня, на который могут переходить валентные электроны с 3s и 3p подуровней).
Таблица №9
| оксид | кислота | Соль | ||
| 17Cl Внорм.=1 В*=3,5,7 | Cl0 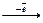 Cl-
Cl0 Cl-
Cl0 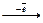 Cl+1
Cl0 Cl+1
Cl0 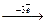 Cl3+
Cl0 Cl3+
Cl0 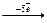 Cl+5
Cl0 Cl+5
Cl0 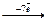 Cl+7 Cl+7
| − Cl2O Cl2O3 Cl2O3 Cl2O7 | HCl HClO хлорноватистая HClO2 хлористая HClO3 хлорноватая HСlO4 хлорная | CaCl2– хлорид кальция NaClO– гипохлорит натрия NaClO2– хлорит натрия NaClO3– хлорат натрия NaClO4– перхлорат натрия |
У инертных газов (He и Ne) p–подуровень полностью заполнен электронами. Теоретически и практически распариваться электронам некуда. Валентность равна нулю (He;Ne).
У 18Ar за счет появления вакантного 3d – подуровня возможны валентности:
Внорм=0; В*=2,4,6,8.
54Xe горит во фторе с образованием: XeF2, XeF4, XeF6, XeF8.
d – элементы - металлы ,так как имеют на последнем электронном уровне 2 электрона, хотя заполнение вакантных орбиталей у них происходит на предвнешнем слое. Их называют переходными, по расположению в периодической системе между s и p элементами, они формируют побочные группы.
Таблица №10
| оксид | основание | Соль | ||
| 21Sс(4s²3d) В*=2,3 Внорм=1 |
Sc0 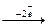 Sc+2
Sc0 Sc+2
Sc0  Sc+3 Sc+3
| ScO Sc2O3 | Sc(OH)2 Sc(OH)3 | ScCl2 ScCl3 |
План характеристики свойств элементов по положению в периодической системе (ПС).
1. Положение элемента в ПС (порядковый номер, период, группа, подгруппа).
2. Строение атома (заряд ядра и его состав) – число протонов, нейтронов, число электронов в атоме, структура электронной оболочки атома, электронная формула валентных уровней, валентность в основном и возбужденных состояниях.
3. Тип элемента (s-, p-, d-, f- элемент), (металл, неметалл), возможные степени окисления, формулы оксидов и гидроксидов для каждого валентного состояния.
Пример: дать характеристику натрия. Порядковый номер его в периодической системе 11, следовательно, заряд ядра атома равен +11, вокруг ядра вращаются 11 электронов. Натрий расположен в третьем периоде, поэтому его электроны располагаются на трех энергетических уровнях. Натрий расположен в I - ой группе, главной подгруппе, следовательно, у атома Na один валентный электрон на внешнем уровне. А если у атома на внешнем энергетическом уровне находится 1,2,3 электрона, то атомы таких элементов являются металлами. Следовательно, Na – металл, его оксид Na2O имеет основной характер. Ему соответствует основание NaOH.
Открытие периодического закона Д.И. Менделеевым и создание им периодической системы химических элементов явились триумфом в развитии химии XIX столетия.
Накопившиеся к тому времени знания о свойствах 63 химических элементах были приведены Д.И. Менделеевым в строгий порядок. С открытием периодического закона появилась возможность предвидеть свойства элементов и их соединений. Д.И.Менделеев на основе открытого им периодического закона предсказал свойства тогда ещё неизвестных элементов: Sc, Ga, Ge, Tc, Re, Po, At, Fr, Ra, Ac, Pa., смог исправить атомные веса уже известных в то время элементов: Be, Ti, Y, In, La.
Периодическая система элементов оказала большое влияние на последующее развитие химии. Она не только была первой естественной классификацией химических элементов, показавшей, что они образуют стройную систему и находятся в тесной связи друг с другом, но и явилась могучим орудием для дальнейших исследований. С течением времени предсказания Д.И.Менделеева блестяще подтвердились. Все предсказанные элементы были открыты и их свойства с поразительной точностью соответствовали ранее описанным.
В настоящее время периодический закон остается руководящим принципом химии. Именно на его основе искусственно создают трансурановые элементы. Один из них – элемент №101, впервые полученный в 1955г. – в честь великого русского ученого был назаван Менделевием.
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА.
План
1. Определение понятия « химическая термодинамика».
2. Основные понятия раздела «химическая термодинамика»:
а) термодинамическая система, виды систем;
б) термодинамические параметры;
в) процесс, классификация процессов;
г) цикл;
д) термодинамические функции.
3. Первое начало термодинамики:
а) изохорный процесс, внутренняя энергия системы
б) изобарный процесс, определение понятия «энтальпия».
4. Термохимия:
а) определение понятия «термохимия»;
б) тепловой эффект химической реакции;
в) основные законы термохимии, закон Гесса.
Литература:
1. Фролов В.В. Химия. Гл.V, §51-56.
2. Лучинский Г.П. Курс химии. Гл.V, §8-12, гл. VI, §13-18
3. Ахметов Н.С. Общая и неорганическая химия. Раздел V, гл.3,4.
4. Общая химия под ред. Соколовской Е.М. и др. Гл.6, §1-11.
Термодинамика – как наука возникла в начале XIX в. (в связи с задачами совершенствования тепловых машин). В переводе с греческого «термос» означает тепло, а «динамос» – силу и мощь. Классическая термодинамика занимается исследованием энергии и работы в макроскопических системах. Этим объясняется ее значение для таких наук, как физика, химия, биология, геология, для многочисленных отраслей техники, так как любые процессы, происходящие в природе, сопровождаются изменениями энергии.
Химическая термодинамика – это раздел химии, который
изучает переходы энергии из одной формы в другую при химических процессах и устанавливает направление и пределы их самопроизвольного протекания при данных условиях.
Термодинамическая химическая система – комплекс взаимодействующих между собой веществ, мысленно обособленный от окружающей среды. Например, системой может быть химический стакан, содержащий определенное количество воды, либо теплообменник, используемый на химическом предприятии и т.д.
Различают три типа термодинамических систем (табл.11).
Изолированныесистемы – не могут обмениваться с окружающей средой ни энергией, ни массой. Например, изолированный термостат, Вселенная в целом.
Закрытыесистемы – могут обмениваться с окружающей средой только энергией, но не массой. Например, совокупность молекул растворенного вещества можно рассматривать как закрытую систему, а в качестве внешней среды может быть все остальное (возможно растворитель, если он не участвует в реакции). Поэтому в химической термодинамике наиболее часто рассматривают именно закрытые системы.
Открытыесистемы – это системы, которые могут обмениваться с окружающей средой и энергией, и массой. Например, живые объекты животного или растительного мира.
Таблица №11
| Изолированные системы | Закрытые системы | Открытые системы |
|
Какую бы систему мы не рассматривали, она может быть в различных состояниях. А чтобы описать то или иное состояние, используют термодинамические характеристики (рис.4). Одни термодинамические характеристики можно рассматривать как основные, которые определяют состояние вещества. Их называют параметрами состояния. Обычно это температура (Т), давление (Р) и количество вещества (n).
Остальные термодинамические характеристики зависят от этих трех параметров (Т, Р, n), а значит в целом и от состояния системы. Поэтому их называют функциями состояния.
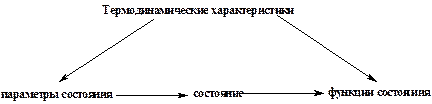
Рис.4
Термодинамический процесс – это всякое изменение параметров состояния (т.е. переход системы из одного состояния в другое). Процессы бывают:
- изохорный (V=const);
- изобарный (P=const);
- изотермический (T=const);
- адиабатный (нет обмена энергией системы с окружающей средой);
- изобарно - изотермический (P;Т=const);
- изохорно - изотермический (V;T=const).
Первое начало термодинамики было сформулировано Джоулем в середине ХIX в. По своей сути это закон сохранения энергии в применении к термодинамическим системам: тепло переданное системе (Q) идет на изменение ее внутренней энергии (DU) и на совершение работы (А): Q=DU+A
Внутренняя энергия системы (U) – это сумма энергии теплового движения молекул, внутримолекулярной энергии и энергии межмолекулярного взаимодействия.
Абсолютное значение этой величины не известно. Поэтому оперируют лишь величинами DU – изменениями внутренней энергии в процессах. DU не зависит от способа перехода системы из одного состояния в другое. Внутренняя энергия является функцией состояния системы.
Что касается теплоты (Q) и работы (А), то это две единственные формы передачи энергии от системы к внешней среде и обратно. Знаки теплоты и работы определяются схемой (рис.5).
1.Q>0; А>0, если система получает теплоту или над ней совершается работа.
2.Q <0; А<0, если система отдает теплоту или сама производит работу.
Соответствующий знак (плюс или минус) ставится не перед буквами Q и А, а перед цифровым значением соответствующей величины, например, Q=-300 кДж или А=+50 кДж.




 Q>0
Q>0
 A>0
A>0
Рис.5
В общем случае ни работа, ни теплота не являются функциями состояния.
Первое начало термодинамики для различных процессов в системе идеального газа.
Изотермические процессы идут при постоянной температуре (T=const).
Для их осуществления расширение или сжатие газа надо сочетать с подведением или забором теплоты так, чтобы температура газа оставалась постоянной. Согласно выражению энергии для идеального газа: U=3/2nRT, внутренняя энергия идеального газа зависит только от температуры. Поэтому при постоянной температуре DU=0, и выражение первого закона термодинамики примет вид: QT = AT.
Таким образом, при изотермическом расширении газа вся подводимая извне теплота трансформируется в работу газа, а при сжатии газа отводимая теплота равна работе, совершаемой над газом.
Адиабатиые процессы – это процессы, при которых исключен теплообмен системы с окружающей средой (Q=0), откуда A= DU. В этих случаях работа становится функцией состояния.
Изохорные процессы (V=const).
Например, нагревание газа под фиксированным поршнем. Естественно, что работа при этом не совершается (А=0), откуда QV = DU.
1.Теплота при изохорных процессах (QV) является функцией состояния системы, т.к. таковой является равная ей величина DU.
2.Это первое математическое выражение закона Гесса (см. далее).
Изобарные процессы (P=const).
Например, нагретый газ совершает работу расширения против постоянного внешнего давления. Работа расширения (АР) определяется как произведение давления (Р) на изменение объема (DV). АР=РDV, откуда: QP=DU + PDV
1.Теплота изобарного процесса (QP) является функцией состояния системы, так как работа против постоянного внешнего давления не зависит от способа совершения процесса, она определяется только начальным и конечным состоянием системы DV. Следовательно, работа является функцией состояния, если в ходе изобарного процесса не совершается никакой иной работы, как против постоянного внешнего давления.
Обозначим сумму (U2 + PV2) через величину Н2, а (U1 + PV1) = H1, тогда QP= H2- H1= DH. Таким образом, в термодинамику введена новая величина Н - энтальпия. Особенность энтальпии состоит в том, что она является функцией состояния. Следовательно, DH= H2 - H1, во всех процессах (как и DU) зависит только от начального (Н1) и конечного (Н2) состояний.
2.Выражение QP = DH это второе математическое выражение закона
Гесса (см. далее).
QP = U2 – U1 + P (V2 – V1) = (U2 +PV2) – (U1 + PV1) = Н2 – Н1 =DH.
Для экзотермических реакций QV > 0, тепло система отдает в окружающую среду, значит, ее внутренняя энергия уменьшается Þ DН < 0.
Дата добавления: 2016-02-27; просмотров: 2726;
