Молярная концентрация эквивалентов вещества (нормальность) показывает сколько молярных масс эквивалентов вещества содержится в 1 л раствора.
СН = N = моль/л = 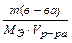
Например,
1 н раствор НС1 → в 1 л раствора содержит 1 молярную массу эквивалента с МЭ(HCl) = 36,5 г/моль.
0,1 н раствор НС1 → в 1 л раствора содержит 0,1 молярной массы эквивалента с МЭ(HCl) = 3,65 г/моль.
0,01 н раствор НС1 → в 1 л раствора содержит 0,01 молярной массы эквивалента с МЭ(HCl) = 0,365 г/моль.
Задача 5. Определить нормальность раствора NaOH, если на титрование 10 мл его расходуется 8,2 мл 0,1 н раствора НС1.
Используя математическое выражение закона эквивалентных
отношений в объемном анализе:N1∙V1 = N2∙V2,записываем выражение:
N(NaOH) ∙V(NaOH)= N(HCl)∙V(HCl)
N(NaOH)= 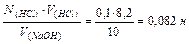
От вет: раствор NaOH 0,082 нормальный, т.е. содержит 0,082молярной массы эквивалента NaOH на один литр раствора (моль/л).
3. Определения жесткости воды:
Жесткость воды показывает количество миллиэквивалентов (мэ/л) растворимых солей кальция и магния, содержащихся в одном литре воды. Ж (Н2О) (мэ/л).
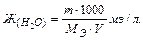
Самостоятельно: виды жесткости воды и способы ее устранения (см. учебник
гл. XIX, § 212, c. 596-599, задачник гл. XI, § 8, с. 232).
Задача 1. Чему равна жесткость воды, в 100 л которой содержится 14,63 г Mg (HCO3)2?
Для решения задачи используем формулу для определения жесткости воды.
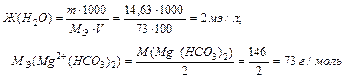
Дата добавления: 2016-02-27; просмотров: 907;
