Всякое чистое вещество, независимо от способов его получения, всегда имеет постоянный качественный и количественный состав.
В качестве примера рассмотрим состав воды: качественный ее состав- она состоит из кислорода и водорода, количественный состав – 88,89% и 11,11%,соответственно.
Она имеет выше приведенный состав независимо от того, как она получена: синтезом из водорода и кислорода, реакцией нейтрализации или из кристаллогидратов.
Оксид углерода (II) СО содержит - 42,88% (масс) С
57,12% (масс) О
Оксид углерода(IV) СО2 содержит - 27,29% (масс) С
72,71% (масс) О
Однако постоянный и неизменный химический состав наблюдается только для молекул (NH3 , SO2), а также кристаллов с молекулярной структурой.
Как вытекает из закона постоянства состава, элементы взаимодействуют между собой в строго определенных количественных соотношениях. В этом случае можно говорить об их эквивалентности (равноценности) при образовании химических соединений.
В) закон кратных отношений
Закон кратных отношений установлен 1803 году Джоном Дальтоном.
Если два элемента образуют между собой несколько соединений, то массы атома одного элемента, приходящиеся на одну и ту же массу атома другого элемента, относятся между собой как небольшие целые числа.
На примере оксидов азота – их 5
Масса кислорода на 1г азота
Отношение массы кислорода, приходящейся на 1г азота к 0,5714 (N2O)
| |
N2O (1∙ 16): (2∙ 14) = 0, 5714
N O (1∙ 16): (1∙ 14) = 1,428
N2O3 (3∙ 16): (2∙ 14) = 1,7143
NO2 (2∙ 16): (1∙ 14) = 2,2857
N2O5 (5 16): (2∙ 14) = 2,8571
Или на примере оксидов серы:
Ar(S) = 32 Ar(O) = 16
1) SO2 m(S) : m(O) = 32 : 32 = 1 : 1
2) SO3 m(S) : m(O) = 32: 48 = 2 : 3
Вопрос 3 . Газовые законы.
A) закон объемных отношений.
Для реакций веществ, находящихся в газовом состоянии и дающих газообразные продукты, действителен не только закон эквивалентов, определяющий отношение масс, но и закон объемных отношений Гей-Люссака (1808г.).
При постоянных давлении и температуре объемы реагирующих между собой газов, а также объемы газообразных продуктов реакции относятся как небольшие целые числа.
Например: 2СО + О2 → 2СО2
Отношение объемов равно:
V (CO) : V(O2) : V(CO2) = 2 : 1 : 2
Б) закон Авогадро.
В 1811 году Амедео Авогадро сформулировал закон, согласно которому в равных объемах различных газов при одинаковых условиях (температуре и давлении ) содержится равное число молекул.
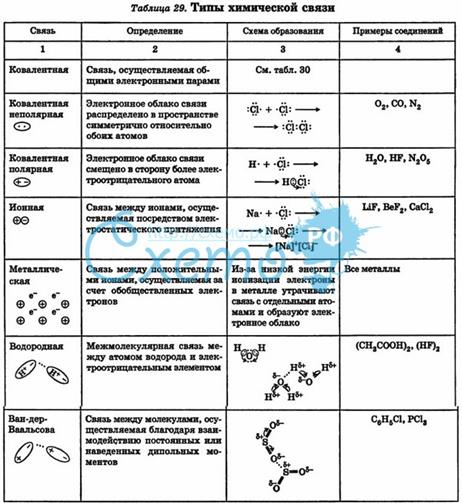
Виды химической связи.
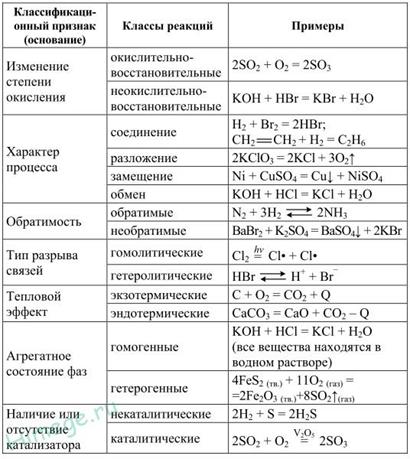
Типы химических реакций. Скорость химической реакции
Дата добавления: 2016-02-24; просмотров: 1998;
