Нахождение в природе. Карбнильные соединения широко распространены в растительном и животном мире, входят в состав эфирных масел
Карбнильные соединения широко распространены в растительном и животном мире, входят в состав эфирных масел, содержатся во многих цветах, фруктах, плодах, душистых и пряных растениях.
Получение.
Большинство реакций получения карбонильных соединений рассмотрены ранее при изучении химических свойств алкенов, алкинов, галогенпроизводных углеводородов, спиртов. Примеры:
1. окисление алкенов(озонолиз)
2. окисление первичных и вторичных спиртов
3. гидролиз геминальных дигалогенпроизводных углеводородов
Из дигалогенпроизводных с атомами галогена при первичном атоме углерода образуются альдегиды, при вторичном - кетоны.
4. гидратация алкинов
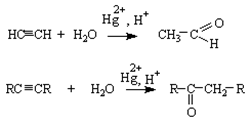
5. термическое разложение кальциевых и бариевых солей карбоновых кислот
6. дегидрирование спиртов
7. оксосинтез. В промышленности значительное количество альдегидов получают присоединением оксида углерода (II) и водорода к углеводородам ряда этилена. Например, из пропилена может быть получена смесь масляного и изомасляного альдегидов
СН3-СН=СН2 + СО + Н2 → СН3-СН2-СН2-СНО + (СН3)2СН-СНО
Изомерия.Для карбонильных соединений характерна структурная изомерия: различное строение углеродной цепи и различное расположение карбонильной группы в цепи. В связи с этим кетоны и альдегиды с одинаковым числом углеродных атомов являются структурными изомерами. Для карбонильных соединений характерна кето-енольная таутомерия, обусловленная существованием двух изомерных форм, находящихся в растворе в динамическом равновесии. Например, для ацетона
СН3-С-СН3 СН2 =С-СН3
|| |
О ОН
кето-форма енол
Содержание в смеси кето-формы, как более стабильной формы, практически всегда больше енольной формы.
Строение. Физические свойства.Атомы углерода и кислорода карбонильной группы находятся в sр2-гибридизации. Двойная связь С=О, подобно связи С=С, представляет собой комбинацию σ-(sр2-sр2- перекрывание) и π-(р-р-перекрывание) связей. При этом связь в карбонильной группе, в отличие от двойной связи в алкенах, характеризуется высокими полярностью и поляризуемостью
R → НСδ+ = Оδ-, что является причиной повышенной реакционной способности альдегидов и кетонов, склонности к гетеролитическому расщеплению связей. Альдегиды и кетоны - полярные соединения. Ассоциация молекул происходит только за счет диполь-дипольного взаимодействия, поскольку образование межмолекулярных водородных связей для карбонильных соединений не характерно. Поэтому, в отличие от спиртов, карбонильные соединения имеют более низкие значения температур кипения и плавления, они менее растворимы в воде.
Химические свойства.Химические свойства карбонильных соединений исключительно разнообразны. Многочисленные реакции, в которые они способны вступать, позволяют получать вещества многих классов. Наиболее характерные реакции карбонильных соединений - реакции нуклеофильного присоединения (АN), окисления-восстановления.
а) реакции нуклеофильного присоединения (АN)
Реакционная активность карбонильных соединений в реакциях этого типа зависит от величины эффективного положительного заряда на карбонильном атоме углерода. Чем больше величина заряда, тем выше реакционная активность соединений в реакциях АN-типа. Изменение активности в ряду метаналь > предельные альдегиды > предельные кетоны > ароматические альдегиды > ароматические кетоны обусловлено увеличением электронодонорного характера радикалов, связанных с карбонильной группой.
Реакции нуклеофильного присоединения протекают в две стадии. Процесс начинается с атаки нуклеофила карбонильного атома углерода. Образующийся на первой стадии тетраэдрический интермедиат присоединяет электрофил и дает продукт присоединения:
Активность карбонильных соединений повышается в присутствии кислотных катализаторов, которые увеличивают положительный заряд на карбонильном атоме углерода:
Примеры реакций.
Присоединение спиртов. Присоединение одной молекулы спирта сопровождается образованием так называемых полуацеталей - неуствойчивых простых эфиров, которые при дальнейшем взаимодействии со спиртом (при нагревании и присутствии катализатора, например HСl) переходят в ацетали. Ацетали устойчивы и могут быть выделены в чистом виде. Это обычно приятно пахнущие, труднорастворимые в воде жидкости. Ацетали в присутствии кислот гидролизуются, образуя исходный спирт и альдегид; в щелочной среде гидролиз не происходит.
Присоединение синильной кислоты. В реакции образуются α-гидроксинитрилы (циангидрины), которые широко используются для получения аминов, α-гидроксикарбоновых кислот, причем получаемые соединения содержат на один атом углерода больше по сравнению с исходными карбонильными соединениями. Плоды некоторых растений (например, горький миндаль) содержат циангидрины.
Присоединение магнийорганических соединений. Реакция лежит в основе получения спиртов разной природы и с большим числом атомов углерода в их составе:
В реакциях с метаналем образуются первичные спирты, с альдегидами - вторичные спирты, с кетонами - третичные спирты.
Аналогично протекают реакции карбонильных соединений с ацетиленом и ацетиленидами с образованием непредельных диолов.
Взаимодействие с гидросульфитом натрия используют для выделения карбонильных соединений из реакционной смеси:
Реакция характерна для альдегидов и тех кетонов, у которых при карбонильной группе находится метильный радикал. В кислой и щелочной средах нерастворимые в воде гидросульфитные соединения разлагаются с образованием исходных карбонильных соединений.
Взаимодействие с соединениями типа NH2-X (Х - Н, -NН2 , -ОН и другие). Особенность реакций с указанными нуклеофилами - продукты присоединения легко отщепляют молекулу воды с образованием
более устойчивых соединений:
Полученные в этой реакции соединения (оксимы, гидразоны, фенилгидразоны и т.д.) широко используются для идентификации карбонильных соединений и для синтеза новых соединений.
Взаимодействие с галогенидами фосфора. В результате этой реакции образуются гем-дигалогенпроизводные, при гидролизе которых вновь образуются карбонильные соединения:
б) окисление - восстановление карбонильных соединений
Альдегиды в этих реакциях проявляют большую реакционную способность, чем кетоны. В реакциях окисления окисляется атом водорода при углеродном атоме карбонильной группы.
Примеры реакций.
Окисление альдегидов слабыми окислителями сопровождается образованием карбоновых кислот с таким же, как в исходном альдегиде, числом углеродных атомов:
R-СН=О + Аg(NН3)2ОН → R-СООН + Аg + NН4ОН + NН3 (реакция «серебряного зеркала»)
R-СН=О + Cu (ОН)2 → R-СООН + Cu2О + Н2О
Обе реакции протекают при нагревании, являются качественными реакциями на альдегидную группу. Кетоны в этих условиях не окисляются, окисление с разрывом углерод-углеродных связей протекает довольно в жестких условиях с образованием соединений (кетоны, карбоновые кислоты), содержащих по сравнению с исходным, меньшее число атомов углерода.
Восстановление карбонильных соединений в зависимости от природа восстановителя и условий реакций происходит до спиртов и углеводородов. При восстановлении альдегидов образуются первичные спирты, кетонов - вторичные спирты.
Под действием концентрированной щелочи альдегиды, у которых отсутствует атом водорода у α-углеродного атома, подвергаются окислительно-восстановительному превращению, приводящему к образованию спирта и карбоновой кислоты (реакция Канниццаро):
Н2С=О + NаОН → Н3 С-ОН + НСООН
в) реакции альдольно-кротоновой конденсации
Для альдегидов и кетонов очень важными являются реакции конденсации, в частности альдольной и кротоновой конденсаций.
Так, альдольная конденсация (А.П. Бородин) идет в мягких условиях (в щелочной или кислой среде). Осуществляется по типу нуклеофильного присоединения, при этом одна молекула карбонильного соединения выступает в качестве субстрата - карбонильной компоненты, другая - в качестве реагента - метиленовой компоненты, имеющей подвижный атом водород в α-положении радикала. В результате возникает новая С-С-связь и образуется вещество, содержащее одновременно альдегидную (или кетонную) и спиртовую группы - альдоль. Процессы альдольной конденсации имеют большое значение для синтетического получения углеводов. И в природе сложный процесс фотосинтеза углеводов в растениях проходит через стадию альдольной конденсации.
Кротоновая конденсация идет в более жестких условиях как реакция замещения атома кислорода карбонильной группы одной молекулы и двух атомов водорода в α-положении другой молекулы альдегида или кетона.
альдоль кротон
Альдегиды вступают в реакции конденсации и с соединениями других классов, например с фенолами, ароматическими аминами и т.д. На этом основано, в частности, очень важное использование их в
промышленности пластических масс.
г) полимеризация альдегидов
Альдегиды, особенно их низшие представители, склонны к полимеризации. Реакция идет с разрывом π-связи альдегидных групп, причем атомы карбонильного кислорода одной молекулы альдегида соединяются с атомами карбонильного углерода другой молекулы. Так, например формальдегид полимеризуется по схеме:
nCH2=O → (-CH2-O-)n
формальдегид полимер (параформ)
При длительном стоянии водных растворов формальдегида, особенно при низких температурах, а также при упаривании в них образуется белый осадок – параформ (или параформальдегид) с величиной n от 10 до 50. При нагревании до 140-160оС параформальдегид деполимеризуется и превращается в газообразный формальдегид, процесс ускоряется в присутствии кислот.
Альдегиды в реакциях полимеризации могут образовать циклические полимеры. Так, из уксусного альдегида образуется жидкий циклический тример (полимер, образованный тремя молекулами мономера), называемый паральдегидом:

этаналь паральдегид
Муравьиный альдегид образует триоксиметилен или тетраоксиметилен:
Описанные процессы полимеризации альдегидов обратимы: при нагревании полимеров, особенно в присутствии следов минеральных кислот, они деполимеризуются и распадаются на молекулы исходного альдегида.
Для ароматических карбонильных соединений характерны химические реакции как по карбонильной группе, так и по бензольному кольцу (SЕ ). При этом в результате взаимного влияния данных групп реакционная активность карбонильных соединений несколько отлична от алифатических альдегидов и кетонов (понижается реакционная активность в реакциях АN-типа, окисления). В реакциях электрофильного замещения карбонильная группа является заместителем 2 рода (электроноакцепторная группа) и ориентирует входящий электрофил в мета-положение.
Применение.Метаналь находит применение в органическом синтезе, производстве синтетических смол (фенолформальдегидная смола), лекарственных препаратов, красителей, дезинфицирующих средств, пласмасс. Этаналь широко применяется в промышленности, органическом синтезе. Ацетон - в производстве взрывчатых веществ, в органическом синтезе широкого круга соединений, в парфюмерии, является прекрасным растворителем самых разнообразных соединений.
Бензальдегид применяют в пищевой промышленности, парфюмерии, в органическом синтезе.
Знаете ли вы, что
-В середине 19 века(1835г.) Либих, действуя различными окислителями на спирты, получил соединения, в которых на 2 атома водорода меньше, чем в исходном спирте, поэтому название полученных соединений - алкоголь дегидрированный или альдегид.
-А.М. Бутлеров в первые получил уротропин - продукт присоединения аммиака к формальдегиду (6:1). При нитровании уротропина образуется сильнейшее взрывчатое вещество - гексоген. Смесь уротропина и хлорида кальция используется в медицине («Кальцекс»), смесь уротропина и парафина является основным компонентом «сухого горючего».
-В 1872 году русский химик и музыкант Александр Порфирьевич Бородин впервые осуществил альдольную конденсацию.
-Как душистые вещества, ацетали используются в парфюмерии. -Небольшое количество ацеталей (50-200 мг/г) образуется в виноградных винах в процессе их "созревания" и "старения" – в результате взаимодействия содержащихся в винах спиртов (главным образом, этилового) с альдегидами (образующихся в вине в качестве продуктов окисления этих спиртов). В числе других веществ ацетали создают характерный аромат ("букет") вин.
-Формальдегид образуется при неполном сгорании различных органических веществ. Он содержится в дыме угля, дерева, на этом основано консервирующее действие дыма при получении мясных и рыбных копченостей. Формальдегид - токсичен.
-Акролеин содержится в дыме, в жаренных продуктах, карамели, сильно раздражает дыхательные пути.
-Многие карбонильные соединения имеют приятные запахи, например фенилуксусный альдегид – запах гиацинта, коричный альдегид - запах корицы, бензальдегид - горького миндаля, гептанон-2 - гвоздичный запах, запах сыра «рокфор», ацетофенон – запах черемухи.
ЛЕКЦИЯ № 12.
Дата добавления: 2016-02-20; просмотров: 3615;
