Химические свойства. Электрофильное замещение.Наиболее характерным превращением для аренов является электрофильное замещение - SЕ
Электрофильное замещение.Наиболее характерным превращением для аренов является электрофильное замещение - SЕ. Реакция протекает в две стадии с образованием промежуточного σ-комплекса:
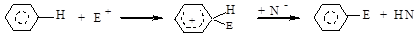
Условиях реакции: температура 60-800С, катализаторы - кислоты Льюса или минеральные кислоты.
Типичные SЕ - реакции:
а) галогенирование (Cl2, Br2):
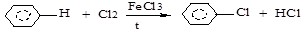
б) нитрование:
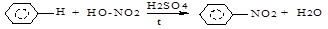
в) сульфирование (H2SO4 , SO3, олеум):
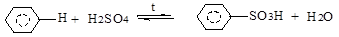
г) алкилирование по Фриделю-Крафтсу (1877г.)( RНal, ROH, алкены):
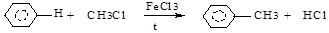
д) алкилирование по Фриделю-Крафтсу (галогенангидриды, ангидриды карбоновых кислот):
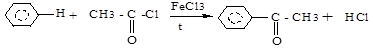
У гомологов бензола в результате влияния бокового радикала (+I-эффект, электронодонорная группа) π-электронная плотность бензольного кольца распределена неравномерно, увеличиваясь в 2,4,6-положениях. Поэтому SЕ -реакции протекают направлено (в 2,4,6- или о- и п-положения). Гомологи бензола по сравнению с бензолом в реакциях этого типа проявляют большую реакционная активность.
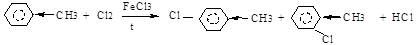
толуол п-хлортолуол о-хлортолуол
Реакции боковых радикалов в алкилбензолах (радикальное замещение - SR и окисление).
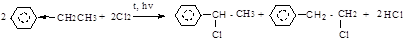 Реакции радикального замещения протекают, как и в предельных углеводородах, по цепному механизму и включают стадии инициирования, роста и обрыва цепи. Реакция хлорирования протекает ненаправлено, реакция бромирования региоселективна - замещение водорода происходит у α-углеродного атома.
Реакции радикального замещения протекают, как и в предельных углеводородах, по цепному механизму и включают стадии инициирования, роста и обрыва цепи. Реакция хлорирования протекает ненаправлено, реакция бромирования региоселективна - замещение водорода происходит у α-углеродного атома.
В алкилбензолах боковая цепь окисляется перманганатом калия, бихроматом калия с образованием карбоновых кислот. Независимо от длины боковой цепи, окисляется атом углерода, связанный с бензольным ядром (α-углеродный или бензильный атом углерода), остальные атомы углерода окисляются до СО2 или карбоновых кислот.
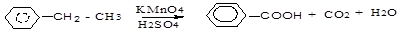
этилбензол бензойная кислота
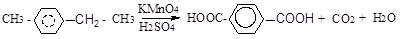
п-метилэтилбензол терефталевая кислота
Дата добавления: 2016-02-20; просмотров: 1529;
