Защитное действие растворов высокомолекулярных соединений.
Типичные гидрофобные золи легко коагулируют при прибавлении к ним малых количеств электролитов (миллиграммы на литр). Растворы высокомолекулярных соединений, наоборот, обладают большой устойчивостью против коагулирующего действия электролитов. Многочисленными исследованиями было установлено, что растворы ВМС, будучи прибавлены к гидрофобным золям, сообщают им повышенную устойчивость к электролитам. Так, если к золю золота (гидрофобный коллоид) прибавить небольшое количество желатина, гидрозоль золота становится более устойчивым. При прибавлении электролитов даже в количествах, значительно превосходящих порог коагуляции, а также при длительном стоянии этот золь не испытывает практически никаких изменений. Если этот золь выпарить, то при смешении сухого препарата с водой вновь образуется коллоидный раствор. Таким образом, типичный гидрофобный золь золота при прибавлении к нему желатина как бы приобрел свойства гидрофильного золя и стал обратимым. Подобное явление получило название защитного действия или просто защиты, а сами вещества, повышающие устойчивость гидрофобных золей, получили название защитных.
Как правило, защитным действием обладают высокомолекулярные вещества лиофильной природы (т. е. поверхностно-активные). Ниже приведены важнейшие защитные вещества и указано, какие гидрофобные золи хорошо защищаются этими веществами (Табл.6.6).

Таблица 6.6 Исследования показали, что степень защитного действия растворов ВМС зависит от природы растворенного полимера и от природы защищаемого гидрофобного золя. Количественной мерой защитного действия растворов ВМС являются золотое, рубиновое и железное число. Золотое число — это минимальное число миллиграммов защищающего высокополимера, достаточное, чтобы воспрепятствовать перемене красного цвета в фиолетовый у 10 мл гидрозоля золота (концентрации 6·10-9 г/л, полученного по методу Зигмонди) от коагулирующего действия 1 мл раствора хлорида натрия с массовой концентрацией 100 г/л.
Золотое число, введенное в практику Зигмонди, рассчитано на самый чувствительный золь — гидрозоль золота. Позднее В. Оствальд в качестве стандарта вместо золотого числа предложил рубиновое число. Оно определяется как минимальное число миллиграммов защищающего золя, которое способно защитить 10 мл раствора красителя конго красного (конгорубина) с массовой концентрацией 0,1 г/л от коагулирующего действия 1 мл раствора хлорида натрия с массовой концентрацией 100 г/л.
Помимо золотого и рубинового чисел, некоторое применение получило еще более простое и легко доступное железное число, которое можно определить как минимальное число миллиграммов защищающего высокополимера, способного защитить 10 мл золя гидроксида железа от коагулирующего действия 1 мл 0,025 М раствора Na2SO4.
Сравнение золотых, рубиновых и железных чисел некоторых веществ представлено в табл. 6.7.
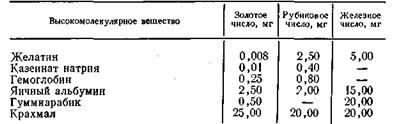
Табл.6.7
 Механизм защитного действия достаточно хорошо объясняется теорией Зигмонди, в основе которой лежит представление об адсорбционном взаимодействии между частицами защищаемого и защищающего золей. Более крупная частица гидрофобного золя адсорбирует на своей поверхности более мелкие макромолекулы ВМС с их сольватными (гидратными) оболочками, и в результате этого она
Механизм защитного действия достаточно хорошо объясняется теорией Зигмонди, в основе которой лежит представление об адсорбционном взаимодействии между частицами защищаемого и защищающего золей. Более крупная частица гидрофобного золя адсорбирует на своей поверхности более мелкие макромолекулы ВМС с их сольватными (гидратными) оболочками, и в результате этого она
Рис.6.18 приобретает лиофильные (гидрофильные) свойства. В дан ном случае коллоидные мицеллы необратимого гидрофобного золя предохраняются от непосредственного соприкосновения друг с другом, а следовательно, и от агрегации как в случае действия на такой золь электролита-коагулятора, так и в случае концентрирования золя. На рис. 6.18, а показана схема подобного защитного действия. Таким образом, высокомолекулярные соединения выступают в роли стабилизатора лиофобных (гидрофобных) золей, То, что именно на адсорбции основано защитное действие, подтверждается не только избирательным характером взаимодействия между макромолекулами ВМС и мицеллами, но и тем, что степень защитного действия увеличивается с концентрацией защищающего раствора ВМС только до полного адсорбционного насыщения поверхности мицелл защищаемого золя.
Исследования, проведенные в последние годы с применением электронного микроскопа, показали, что в случае нитевидных молекул ВМС одна макромолекула высокополимера адсорбционно взаимодействует с несколькими мицеллами (рис. 6.18,б). При этом мицеллы гидрофобного золя связываются в своеобразные агрегаты в виде структурных сеток, вследствие чего лишаются возможности сближаться друг с другом и коагулировать.
Коллоидная защита играет очень важную роль в ряде физиологических процессов, совершающихся в организмах человека и животных. Так, белки крови являются защитой для жира, холестерина и ряда других гидрофобных веществ. При некоторых заболеваниях содержание защитных белков в крови уменьшается, что приводит к отложению, например, холестерина и кальция в стенках сосуда (артеросклероз и кальциноз). Понижение защитной роли белков и других стабилизирующих веществ в крови может привести к образованию камней в почках, печени, протоках пищеварительных желез и т. п. С другой стороны, способность крови удерживать в растворенном состоянии большое количество газов (кислорода и углекислого газа) также обусловлена защитным действием белков. В данном случае белки обволакивают микропузырьки этих газов и предохраняют их от слияния.
Большое значение защитное действие имеет и в технологии многих производств. Так, при изготовлении ряда фармакологических препаратов, например колларгола и протаргола, используется явление защиты. Эти препараты представляют собой концентрированные золи металлического серебра, защищенного от выпадения добавкой декстрина и белковых веществ.
Путем введения в вино защитных коллоидов добиваются значительного удлинения сроков хранения вин без потери ими прозрачности. На явлениях защиты основано придание пенистости пиву в пивоваренном производстве, а также образование очень стойких пен в огнетушителях.
В органическом синтезе широко используются в качестве катализаторов защитные золи таких металлов, как платина, палладий и др. Защитные коллоиды используются также при приготовлении фотографических эмульсий. В кондитерском производстве в целях предотвращения образования крупных кристаллов сахара и льда при приготовлении мороженого широко применяется желатин.
Кроме органических защитных веществ известны и неорганические. Так, получены стойкие золи Pb, Se, Fe, Au, Rh, Bi, Sb, стабилизированные оловянной или титановой кислотой. Такой краситель, как, например, кассиев пурпур, является гидрозолем золота, защищенным оловянной кислотой.
Дата добавления: 2016-02-20; просмотров: 2670;
