КОЛИЧЕСТВЕННЫЙ АНАЛИЗ И
СВОЙСТВА ФЕРМЕНТОВ
11.1. Общие замечания. Из курсов химии известно, что катализ – процессвозбуждения и ускорения химических реакций, а термин ингибитор (лат. inhibire – угнетать) – несет обратный смысл.
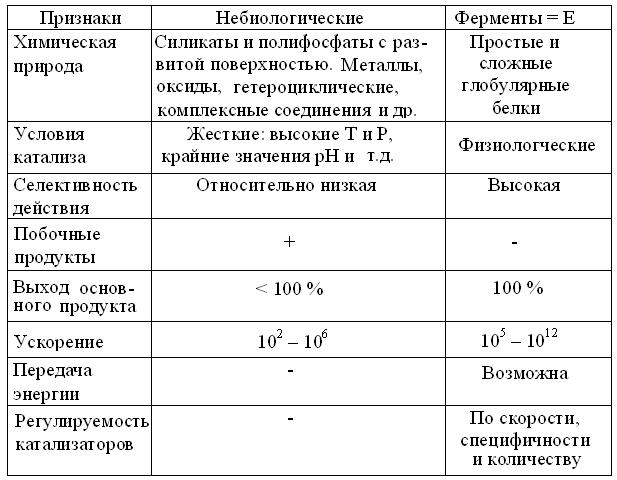
Функция катализаторов состоит в реакциях с исходными веществами = субстратами, с образованием промежуточных соединений в новых переходных состояниях, способных: образовать продукты при сниженной энергии активации и регенерировать катализатор. Поэтому катализатор участвует в реакции многократно и в стехиометрии реакций = количественном соотношении их компонентов, его нужно гораздо меньше, чем субстратов. Механизмы химического и биологического катализа принципиально одинаковы, но в физиологических условиях водных растворов, ферменты гораздо эффективней (табл. 11.1), т.к. намного больше снижают свободную энергию переходного состояния и имеют ряд других преимуществ.
Таблица 11.1
Сравнение свойств катализаторов (по А. Lehninger, 1974, с изменениями)
Причины высокой эффективности биокатализа суммирует схема (рис. 11.1). Очевидно, что относительное пространственное соответствие функциональных групп, позволяет без затрат энергии связать субстрат(ы), сразу в нескольких точках активного центра Е. Образование фермент-субстратного комплекса вызывает ряд множественных эффектов. Так, межмолекулярные отношения сменяются внутримолекулярными, а гетерогенный катализ – гомогенным, изолируя субстрат от водной среды. Параллельно индуцируется полная комплементарность между функциональными группами Е и субстрата (D. Koschland), что в свою очередь, деформирует в последнем ковалентные связи и оптимизирует возможности полифункционального катализа.
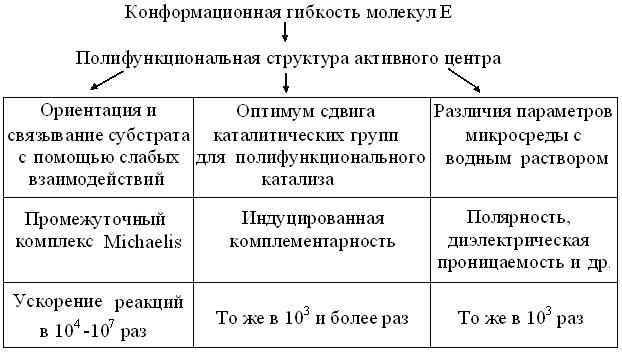
Рис. 11.1. Схема множественности эффектов биокатализа
Из-за отсутствия специфических индикаторов, о наличии и каталитической активности Е судят во времени, по скорости убывания субстрата или нарастания количества продукта. В системе СИ основной каталитической единицей принят катал (символ – кат.), т.е. способность ускорять реакцию на 1 моль/с, в заданной системе измерения активности. Так как для практических целей эта единица слишком велика, обычно используют ее степенные производные: микрокатал (мк-кат = 1 мкмоль/с), нанокатал (нкат = 1 нмоль/с) и пикокатал (пкат = 1 пмоль/с). К производным величинам относят: удельную и молярную каталитическую активности, соответственно, кат/кг ферментного препарата и кат/моль Е.
Хотя комиссия по номенклатуре Международного биохимического союза не рекомендует применять международные единицы активности Е, связанные с именами разработчиков систем их тестирования, например единицы Вольгемута для амилазы и т.п., они еще встречаются в литературе. Для пересчета их в систему СИ и обратно, полезны эмпирические формулы:

Благодаря высокой избирательности и активности, Е, в частности микроорганизмов, издавна широко применялись в таких традиционных биотехнологиях, как хлебопечение, сыро- и виноделие, выделка кож и тканей, компостирование и т.д. Появление методов количественного анализа Е, а потом индивидуальных и сопряженных индикаторных ферментных реакций (табл. 4.3), обеспечило точный количественный экспресс-анализ метаболитов для лабораторной и промышленной диагностики. Наконец, совершенствование методов иммобилизации Е в мицеллах, гелях т.д., привело к новым биотехнологиям, связанным с их применением в колонках, проточных реакторах и пленочных = мембранных электродах.
Дата добавления: 2016-02-16; просмотров: 849;
