И ДИАГНОСТИЧЕСКАЯ РОЛЬ ГЛЮКОЗЫ
13.1. Вводные замечания.Известно, что к углеводам относят полигидроксикарбонильные соединения c их производными. Иначе говоря, это альдегиды и кетоны многоатомных спиртов = полиолов, названия которых тривиальны, а групповой признак – окончание «оза». Они входят в состав всех надцарств биоты, но, если у прокариот и животных доля углеводов составляет порядка 2 %, то у растений она может достигать свыше 80 % сухой биомассы. То есть, углеводы – самый обширный и доступный класс биомолекул Земли, доля которых в пищевом рационе консументов составляет 70 – 90 %.
Мед, крахмал, тростник, хлопок, лен, древесина и т.д., издавна служат ряду животных и людям не только пищей, но и строительным = пластическим материалом, а частью и топливом. Широко применяя углеводы в медицине, целлюлозно-бумажной, текстильной, пищевой и химической промышленности, люди выделили эти биомолекулыв чистом виде свыше 200 лет назад. Раньше других веществ «сахара» стали сбраживать и гидролизовать, но, брутто-формулы их элементного состава Сn(H2O)n, к сожалению, дали тоже неточный термин «углеводы», через который уже полвека пробивается предпочтительное «глициды». Их структура, стереохимия и свойства рассмотрены в курсе органической химии и, повторно, в занятиях 4, 5 и 9. Поэтому ограничимся схемой (рис. 13.1) и, по возможности кратким комментарием.
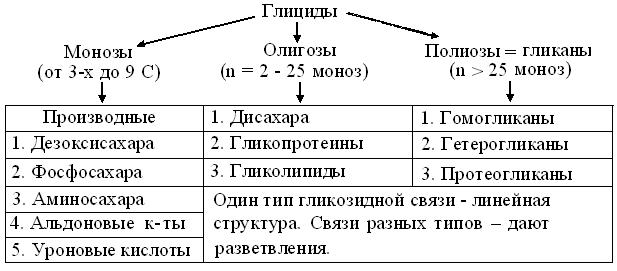
Рис. 13.1. Схема классификации глицидов
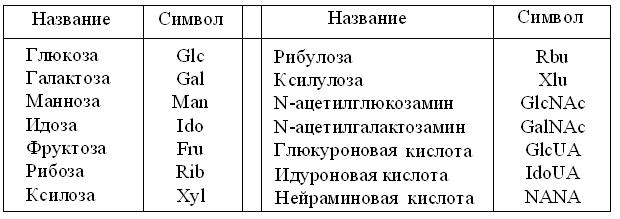
Подкласс моноз и их производных образуют негидролизуемые глициды. По определению, в них не бывает меньше 3 С, поэтому простейшие из них – триозы: глицеральдегид и его изомер дигидро-ксиацетон. Для различия изомеров, суффикс «ул» применяют чаще приставки «кето». Например, рибоза и рибулоза. Для упрощенной записи их структуры предложены трехбуквенные символы (табл. 13.1). Т.к. молекулы моноз высокополярны но электронейтральны, ясно, что химические модификации их структуры влекут и соответствующие изменения свойств. Наконец, оптимальные сочетания энергоемкости и стабильности циклических форм пентоз и гексоз, сделали эти монозы самыми распространенными в биосфере.
Таблица 13.1
Символы записи важнейших моноз и их производных
(по Д. Г. Кнорре и С. Д. Мызиной, 1992, с изменениями)
Глюкоза, как первичный продукт фотосинтеза, служит своеобразным мостом между окружающей средой и биоорганикой. Прежде всего, она мономер и структурная основа всех прочих глицидов. С другой стороны, легкость еебиологического окисления, как в анаэробных, так и аэробных условиях, обеспечивает все клетки не только необходимыми межуточными метаболитами, но и позволяет аккумулировать химическую энергию в виде взаимоконвертируемых трансмембранных потенциалов и макроэргических соединений, из которых наиболее известна АТФ. Последняя прямо используется в реакциях биосинтезов или преобразуется, либо в векторный транспорт веществ через биомембраны, либо в механическую работу. Понятно, что и в этих случаях, гидролиз любых ма-кроэргов неизбежно сопровождается выделением тепла.
Большинство пентоз и гексоз, возникающих из Glc, служит мономерами в реакциях биосинтеза нуклеотидов и множества олиго- и полиоз. Все они (рис. 13.1) возникают путем конденсации полуацетальной гидроксигруппы при С 1с любым гидроксилом другой монозы, по принципу «одна связь – один Е». Такую связь называют О-гликозидной, а соответствующие продукты – гликозидами.
Структура и свойства самых распространенных водорастворимых дисахаров (табл. 13.2) выявляют разницу между их нередуцирующими и редуцирующими формами. Так, трегалоза и сахароза не имеют полуацетальных гидроксилов, а мальтоза и лактоза сохраняют их на восстанавливающем конце. Соответственно, 2 первых не дают реакций, свойственных оксогруппам, тогда как прочие, как и монозы, способны к мутаротации, образованию озазонов, реакциям окисления, восстановления и поликонденсации.
При сравнительной оценке степени сладости сахаров, за эталон = 1,0 принята сахароза. У фруктозы она соответствует ~1,25; у глюкозы – 0,7; мальтозы – 0,6 и лактозы – 0,25.
Таблица 13.2
Состав и структура распространенных дисахаров
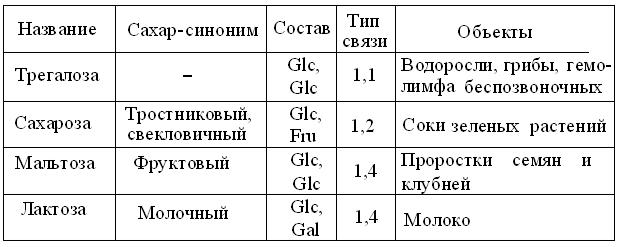
Лактоза и более сложные, аминосодержащие формы олигоз молока играют важную роль в формировании кишечной микрофлоры новорожденных млекопитающих. Способствуя развитию в ЖКТ культуры Lactobacillus bifidus и, соответственно распадаясь до смеси молочной и уксусной кислот, они препятствуют размножению патогенных бактерий, типа тифозных. Поэтому стоит отметить, что на 1 л женского молока приходится 70 г лактозы и 3 г аминоолигоз, тогда как в коровьем молоке, последних в 100 раз меньше.
Олигозы гликопротеинов и гликолипидов обычно уступают в размерах и массе своим молекулам-носителям. Они гетерогенны по составу и сильно ветвятся. Наличие ковалентных N- или О-гли-козидных связей позволяет объединять их термином гликоконъюга-ты. Как правило, конъюгация модифицирует свойства носителей, улучшая их растворимость в воде и меняя другие физико-хими-ческие параметры, например, повышая вязкость слизей = муцинов или играя роль антифризов у антарктических рыб. Другие примеры этой функции: большинство белков плазмы крови; гликокаликс внешних поверхностей клеток и конъюгаты гидрофобных молекул билирубина, стероидов и ксенобиотиков. Ряд гликоконъюгатов, из которых наиболее известен стрептомицин, служит антибиотиками. Наконец, гликоконъюгаты участвуют в системах клеточного узнавания и адгезии, играя роль антигенных детерминант в процессах гистогенеза и реакций иммунитета.
Полиозы = гликаны возникают при поликонденсации моноз и составляют основу глицидов растительной биомассы. От белков и нуклеиновых кислот они отличаются тем, что, включая до 105 мономеров, могут быть как гомо-, так и гетерополимерами линейной или разветвленной структуры. Разнообразие их строения и свойств привело к функциональному делению на запасные = резервные и структурные гликаны. Т.к. с этими вопросами знакомят еще в школе, а подробно разбирают в курсе физиологии растений, таблица 13.3 суммирует лишь структуру внутриклеточных запасных гомогликанов.
Таблица 13.3
Характеристика запасных гомогликанов α-D-глюкопиранозы

Структурные гомо- и гетерогликаны клеточных стенок = оболочек клеток бактерий, грибов, растений и экзоскелета членистоногих, ракообразных и насекомых, обычно делят на основные, т.н. «арматурные» и вспомогательные, «цементирующие» арматуру в единое целое с клеткой или организмом и, сильно зависящие от видовой принадлежности. Поэтому в таблицу 13.4 вошли лишь линейные «арматурные» гомогликаны с высокой (1-2 тыс. мономеров) степенью полимеризации. Самый распространенный из них – целлюлоза, составляющая половину сухой массы древесины и почти 100 % хлопковой ваты. Установлено, что в ее микрофибриллы входит до 40 смежных цепей, закрепленных при помощи множества Н-связей. Сочетаясь со вспомогательными гликанами клеточных стенок (гемицеллюлозы, лигнины, пектины, ксиланы, камеди и др.), антипараллельные слои микрофибрилл образуют пучки растительных волокон, различимых невооруженным глазом. Это и создает уникальную механическую прочность, позволяющую существовать деревьям гигантского размера. По имеющимся оценкам, за год на Земле воспроизводится порядка 1011 тонн целлюлозы.
Таблица 13.4
Характеристика основных гомогликанов клеточных стенок
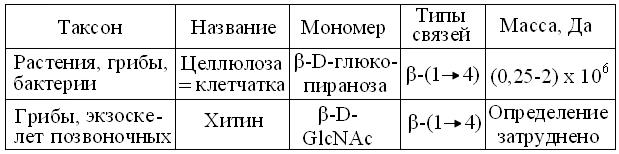
Аналогично целлюлозе, повсеместно распространен хитин беспозвоночных и грибов, тоже формирующий многослойные волокнистые структуры. Однако в нем цепи гомогликана послойно чередуются с белками, фиксируясь ковалентными сшивками. Пока, это затрудняет даже определение его молекулярной массы. Фундаментальные различия в организации клеточных стенок бактерий, которые рассматривают в курсе микробиологии, свидетельствуют, что комбинации гликанов с белками и пептидами позволяют формировать гораздо большее разнообразие структур, чем сочетания разных гликанов, характерные для высших растений.
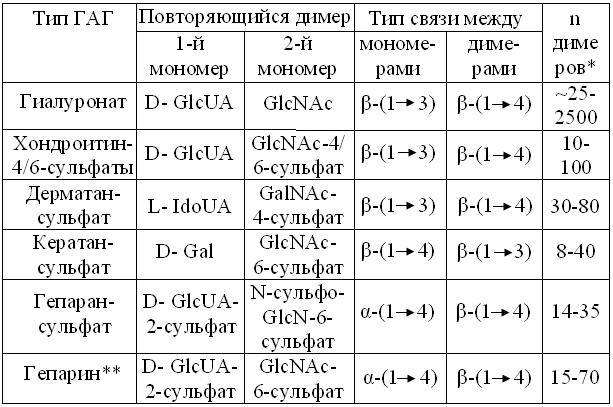
В отличие от гликопротеинов, протеогликанами называют сугубо межклеточные комплексы = агрегаты, лучшей моделью которых служит бедный клеточными элементами матрикс соединительной ткани позвоночных животных. Доля белка в протеогликанах обычно составляет лишь 5-15 % сухой массы. Другой отличительный признак – преобладание одного или нескольких линейных гетерогликанов с кислыми свойствами (табл. 13.5). Они и обусловили устаревший термин кислые мукополисахариды, замененный более адекватным гликозаминогликаны = ГАГ.
Таблица 13.5
Характеристика гликозаминогликанов межклеточного вещества
позвоночных животных
* Данные ориентировочны, т.к. порядок величин зависит от объекта, типа ткани и метода выделения препарата.
** Водорастворимый компонент плазмы.
Из таблицы 13.5 видно, что при разном составе мономеров – производных гексоз и различиях способов и степени полимеризации, линейные молекулы ГАГ всех типов состоят из монотонно чередующихся димеров. Как правило, первый в нем – остаток уроновой кислоты, придающий димеру кислые свойства. Очевидно, что наименьшей кислотностью обладают молекулы гиалуроновой кислоты и кератансульфата, т.к. в остальных случаях, в отличие от хитина, второй, а то и первый член димера снабжен разным числом остатков серной кислоты, повышающих плотность отрицательных зарядов и кислые свойства ГАГ.
Единственный из ГАГ, способный существовать в водных растворах в почти чистом виде – гиалуроновая кислота стекловидного тела глаза и синовиальной жидкости сухожилий и суставов. Понятно, что отрицательные заряды GlcUA, равномерно распределенные по длине полимера, вынуждают его молекулы к растянутым конформациям. С другой стороны, циклические формымономеров, помноженные на степень их полимеризации и сильную гидратацию, позволяют молекулам гиалуроната занимать довольно большие объемы пространства. Наконец, склонность к адгезии и высокая вязкость раствора, делают его почти идеальным заполнителем межклеточных пространств гелеподобного матрикса.
Также, длинные и растянутые молекулы гиалуроната служат центром = организатором протеогликановых агрегатов (рис. 13.2). Сорбируя по длине своей молекулы (1) глобулы т.н. связывающих белков (2), он допускает присоединение к ним почти под прямыми углами, фибриллярных = коровых или сердцевинных белков (3), массой ~ 40-60 кДа и длиной ~100-400 нм. К ним и прикрепляются
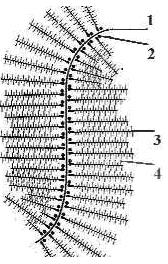
| линейные молекулы ГАГ прочих типов (4), подобно «ершу» для мытья посуды. Такая организация межклеточного вещества позвоночных животных позволяет создавать гигантские протеогликановые агрегаты с массой более 2500-3500 кДа. Вариации их состава и размеров, разное число и степень агрегации коллагеновых и эластиновых волокон, как и набор и кооперация клеток, обеспечивают различную степень упорядоченности, механические свойства и функции тканей. |
Рис. 13.2. Схема строения протеогликановых агрегатов
Глюкозооксидазный метод определения глюкозы в био-жидкостях с помощью тест-наборов фирмы Lachema (Чехия)
Он возможен без осаждения белков плазмы, но при определении глюкозы в цельной крови, плазме и сыворотке с признаками гемолиза, липемии и желтухе = иктерии, субстраты предварительно депротеинизируют. Поэтому целесообразно привести более полный вариант анализа.
Принцип метода: Белки проб осаждают депротеинизирующим раствором, содержащим уранилацетат, токсичный, как все соли тя-желых металлов! ВНИМАНИЕ!!!При попадании раствора внутрь, немедленно выпить 0,5 л воды и вызвать рвоту, а затем действовать по пункту 1.1.31. В соответствии со схемой (рис. 13.3), ФАД-зависимый Е микробного происхождения глюкозооксидаза в роли биосенсора, специфично окисляет глюкозу в безбелковом надосадке, а затем регенерирует ФАДН2 с помощью кислорода атмосферы. Т.к. сходство структуры и свойств глюкозы и глюконовой кислоты затрудняют их различение, обычно определяют эквимолярную концентрацию пероксида водорода. В данном методе это делают с помощью сопряженной пероксидазной реакции азосочетания, после чего, против воды и стандарта = эталонного раствора глюкозы, фотометрируют интенсивность окраски продукта.
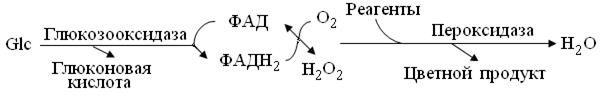
Рис. 13.3. Схема ферментного анализа количества глюкозы
Ход работы: 1. В маркированную центрифужную пробирку внести 0,5 мл раствора 2 (смесь 0,02 М уранилацетата в 0,82 М хлориде натрия).
2. В соответствии с п. 3.3.1, с помощью полуавтоматического дозатора добавить в пробирку 50 мкл цельной крови с антикоагулянтом, перемешать и оставить в штативе на 10 мин.
3. Согласно п. 6.3.1., попарно уравновесить пробирки на центрифужных весах и разместить их в гнездах по диаметру ротора центрифуги.
4. Убедившись, что все студенты выполнили пп. 1-3, дежурный закрывает центрифугу крышкой и, соблюдая п. 1.1.20, включает ее при 1500 об/мин на 15 мин.
5. Во время центрифугирования, в 2 пробирки внести по 0,5 мл раствора уранилацетата и, меняя наконечники, добавить дозатором в контроль – 50 мкл дистиллята, а в эталон – 50 мкл раствора 1 (стандарт глюкозы с концентрацией 10 ммоль/л).
6. После центрифугирования, из пробирок, меняя наконечник дозатора, соответственно таблице в 3 маркированных пробирки вносят:
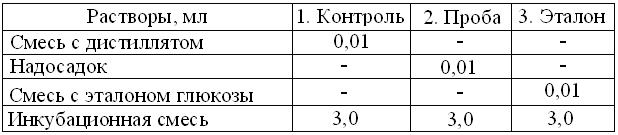
7. Пробы перемешать и поместить в термостат при 37 С на 30 мин.
8. За 10 мин до окончания инкубации, в соответствии с работой 4.3.1, включить для прогрева ФЭК КФК-2,
9. Фотометрировать пробы 2 и 3 против контроля, при λ = 480 нм в кюветах толщиной 5 мм. Результаты измерений абсорбции = А занести в протокол опыта.
10. В соответствии с формулой: Глюкоза, ммоль/л = 10 х А2/А3, где: А2 – абсорбция пробы и А3 – эталона, рассчитать ее концентрацию в крови и сделать выводы из работы.
12.3.2. Определение глюкозы в крови с помощью экспресс-анализатора Эксан-Г (Литва)
Принцип метода: Е-биосенсор – та же глюкозооксидаза, что и в предыдущей работе. Но, ее не вносят в раствор, а заранее иммобилизуют в геле на пленке = мембране, снабженной резиновым кольцом. Перед началом эксплуатации прибора, мембрану с помощью кольца фиксируют на торце датчика - кислородного электрода Кларка, вмонтированного в проточную измерительную ячейку. Количество продукта реакции – Н2О2, эквимолярно не только концентрации глюкозы, но и расходу кислорода в пространстве между мембраной и электродом. Поэтому, возникший на нем электрохимический потенциал, с помощью уравнения Нернста «вшитого» в микросхему, преобразуется в ммоль/л глюкозы и выводится на табло прибора. После ручной или автоматической регистрации показаний, для подготовки прибора к новому циклу работы, измерительную ячейку промывают буферным раствором.
Примечания: 1. В процессе хранения и эксплуатации устройства, иммобилизованный Е неизбежно денатурирует. Поэтому запасные мембраны хранят в холодильнике, с гарантированным временем работы 80 ч, а в конструкции прибора предусмотрены 3 уровня чувствительности.
2. В соответствии с «Инструкцией по эксплуатации анализатора глюкозы «Эксан Г», заливку буферного раствора и заправку мембраны в датчик, до начала занятий проводит лаборант.
3. Также, лаборант включает прибор в электросеть и, после каждого включения, калибрует его с помощью 50 или 20 мкл доз эталонного раствора глюкозы.
Ход работы: 1. Кнопкой «Промывка» на лицевой панели при-бора включить перистальтический насос и, промыть измерительную ячейку буферным раствором. Окончание промывки через 90 с, ограничивает автоматика устройства.
2. Нажать на лицевой панели прибора кнопку «Сброс» и убедиться, что на табловысветились цифры «0.00». Отклонение от «правого нуля» на 2-3 единицы допустимо. Если же высветилось другое –нажать кнопку «Сброс» и повторить п. 1. При высвечивании других цифр и неустойчивости показаний – обратиться к лаборанту или преподавателю.
3. Под контролем лаборанта, из пробирки с образцом цельной крови с антикоагулянтом, набрать в наконечник полуавтоматического дозатора 50 или 20 мкл
4. Ввести наконечник дозатора в коническое отверстие проточной кюветы и, плавно нажав кнопку дозатора до второго упора, внести дозу крови в измерительную ячейку.
5. Не отпуская кнопки, вывести наконечник дозатора из проточной кюветы, отпустить кнопку, сбросить в маркированную тару использованный наконечник и поставить дозатор в штатив.
6. Через 5-10 секунд после введения пробы, появившиеся на табло показания прибора занести в протокол работы.
7. Повторить пп. 1 и 2 данной инструкции и, за время подготовки прибора к новому циклу работы, убрать рабочее место.
8. По окончании работы всех студентов с анализатором, поставить в известность об этом лаборанта.
9. Завершить оформление протокола выводами.
12.3.3. Определение глюкозы в крови с помощью автономного экспресс-измерителя ПКГ-02-«Сателлит» (Россия)
Принцип метода: Миниатюрный глюкометр работает от внутреннего источника = батарейки напряжением 3 В, управляется с помощью одной кнопки, но зависит от одноразовых электрохимических полосок ПКГЭ-02, изготовленных на основе «сухой химии». Это позволяет применять его в полевых условиях, при чрезвычайных ситуациях, скрининге и оперативном контроле индивидуального пользования. Но, показания прибора должно рассматривать лишь как ориентировочные, требующие подтверждения лабораторным методом и не дают оснований изменять дозировку лекарств без ведома врача. Поэтому можно лишь предполагать, что биосенсор полосок – все та же глюкозооксидаза, иммобилизованная в геле, степень сшитости которого исключает влияние белков и форменных элементов крови. Судя по скорости анализа, химический сигнал преобразуется в электрическую форму, тоже по принципу кислородного электрода Кларка.
Технические характеристики:
1. Диапазон показаний прибора от 1,8 до 35 ммоль/л глюкозы.
2. Объем памяти – 40 последних показаний.
3. Режим хранения и пользования прибором ПКГ-02-«Сателлит», в комплекте с одноразовыми полосками ПКГЭ-02, изложен подробно в прилагаемых к устройству Инструкции и Руководству по эксплуатации.
Противопоказания к применению:
1. Анализ сыворотки, венозной, разведенной, сгущенной или хранившейся крови.
2. Анализ после приема внутрь > 1 г аскорбиновой кислоты и у больных с инфекциями, массивными отеками и злокачественными опухолями.
3. Полоски с просроченным сроком годности или несовпадением их пятизначного кода с кодом, хранящимся в памяти прибора.
Ход работы: 1. Достать из футляра прибор и полоски, разместив их на ровной поверхности.
2. Убедиться, что срок годности полосок не истек.
3. Надорвать края индивидуальной упаковки полоски, снять ее меньшую часть, закрывающую контакты, проводниками вверх, вставить полоску в гнездо прибора и, удалить остальную часть упаковки.
5. Нажать и отпустить кнопку прибора.
6. В случае несовпадения кодов полоски и высветившегося на табло – действовать соответственно инструкции к устройству.
7. При совпадениении кодов – повторно нажать и отпустить кнопку прибора. Появление на табло цифр «88.8» – признак готовности устройства к работе.
8. Обработать подушечку 4-го пальца кисти спиртосодержащим тампоном и, подсушив ее, проколоть кожу одноразовым стерильным скарификатором.
9. Выдавив каплю крови на пальце, аккуратно коснуться ею рабочей зоны полоски, добившись ее полного смачивания.
10. Звуковой сигнал прибора и мелькающие на табло цифры обратного счета свидетельствуют, что образец включен в анализ.
11. Через 40 секунд на табло высветится измеренная концентрация глюкозы, которую заносят в протокол опыта.
12. В третий раз нажать и отпустить кнопку прибора. Погасшее табло свидетельствует, что прибор выключен, а результат анализа включен в его память.
13. Извлечь использованную полоску и, убрать за собой рабочее место.
Дата добавления: 2016-02-16; просмотров: 1355;
