БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ 19 страница
Химико-ферментативные способы получения аминокислот
При получении ряда аминокислот химико-ферментативными способами используют энзимы, принадлежащие к разным классам. Эти процессы могут быть как одностадийными (конверсии), так и многостадийными. Источником ферментов для большинства процессов служат энзимы микроорганизмов — как индивидуальные, так и их природные смеси, содержащиеся в интактных (не растущих), высушенных и лизированных клетках, клеточных экстрактах и, наконец, в препаратах иммобилизованных клеток и ферментов. Использование иммобилизованных ферментов в биотехнологии будет рассмотрено в гл. 4.
Применение ферментов в производстве аминокислот обеспечивает стереоспецифичность процессов их синтеза, что выгодно отличает биотехнологические производства от химических. Далее будут рассмотрены примеры, иллюстрирующие эти положения.
Получение L-лизина. Процесс получения лизина основан на стереоспецифическом ферментативном гидролизе (конверсии) 0-,Ь-а-амино-е-капролактама, который сначала получают химическим путем из циклогексена:
/0Н
N CI N NHj ;. NH,
D-.L-a-амино-Е-капролактам
Рацемат используют в качестве субстрата, который под действием фермента L-a-амино-е-капролактамгидролазы (лактамаза) превращается в L-лизин, а оставшаяся непрореагировавшая его часть (D-форма) переводится при воздействии рацемазы в смесь антиподов:
о
Г nh2
/ \ Лактамаза^ h2N-(ch2)4-ch(nh2)-cooh
^----- ' 1-лизин
Рацемическая смесь „ +
гЯ НРМЯЧЯ
D- и L-a-амино-е- ----------------------- D-a-амино-е-капролактам
капролактама

Лактамаза найдена у некоторых видов дрожжей, в частности у Candida laurentii; у них синтез фермента индуцируется добавлением субстрата (рацемической смеси), а активность энзима поддерживается при добавлении в среду ионов Mg2+, Мп2+ и Zn2+. Раце-
рогёназы, лиазы, лигазы, изомеразы. Столь же разнообразен и перечень целевых аминокислот, производимых химико-фермен- тативным способом (L-аспарагиновая кислота, L-аланин, L-глу- тамиН, L-лизин, L-тирозин, L-триптофан, L-цистеин, L-фени- лаланин, L-метионин). Химико-энзиматический способ в сравнении с микробиологическим более специфичен, не требует процедуры очистки аминокислот от побочных продуктов и сточных потоков. Однако по стоимости сырья и ферментативных препаратов он еще уступает микробиологическому способу.
3.4.2. Производство витаминов
Витамины представляют собой группу незаменимых органических соединений различной химической природы, необходимых любому организму в ничтожных концентрациях и выполняющих в нем каталитические и регуляторные функции. Недостаток того или иного витамина нарушает обмен веществ и нормальные процессы жизнедеятельности организма, приводя к развитию патологических состояний. Витамины не образуются у гетеротрофов. Способностью к синтезу витаминов обладают лишь автотрофы, в частности растения. Многие микроорганизмы также образуют целый ряд витаминов, поэтому синтез витаминов с помощью микроорганизмов стал основой для разработки технологий промышленного производства этих биологически активных соединений.
Благодаря изучению физиологии и генетики микроорганизмов — продуцентов витаминов и выяснению путей биосинтеза каждого из них создана теоретическая основа для получения микробиологическим способом практически всех известных в настоящее время витаминов. Однако с помощью энзимов целесообразнее производить лишь особо сложные по строению витамины: В2, В12, Р-ка- ротин (провитамин А) и предшественники витамина D. Остальные витамины либо выделяют из природных источников, либо синтезируют химическим путем. Витамины используются в качестве лечебных препаратов, для создания сбалансированных пищевых и кормовых рационов и для интенсификации биотехнологических процессов.
Получение витамина В2 (рибофлавин). Вплоть до 30-х годов прошлого столетия рибофлавин выделяли из природного сырья. В наибольшей концентрации он присутствует в моркови и печени трески. Из 1 т моркови можно изолировать лишь 1 г рибофлавина, а из 1 т печени — 6 г. В 1935 г. обнаружен активный продуцент рибофлавина — гриб Eremothecium ashbyii, способный при выращивании на 1 т питательной смеси синтезировать 25 кг витамина В2. Сверхсинтеза рибофлавина добиваются действием на дикие штаммы мутагенов, нарушающих механизм ретроингибирования синтеза витамина В2, флавиновыми нуклеотидами, а также изменением состава культуральной среды. Отбор мутантов ведут по устойчивости к аналогу витамина В2 — розеофлавину. Вопросы биосинтеза рибофлавина и его регуляции детально изучены в работах Г. М. Шавловского.
В состав среды для роста продуцентов витамина В2 входят достаточно сложные органические вещества — соевая мука, кукурузный экстракт, сахароза, карбонат кальция, хлорид натрия, гидрофосфат калия, витамины, технический жир. Грибы весьма чувствительны к изменению состава среды и подвержены инфицированию. Перед подачей в ферментер среду подвергают стерилизации, добавляя к ней антибиотики и антисептики. Подготавливают жидкую питательную среду и посевной материал культуры дрожжей в разных емкостях — ферментере и посевном аппарате.
В качестве посевного материала используют споры Е. ashbyii, выращенные на пшене (7 —8 дней при 29 — 30 °С). После стерилизации жидкий посевной материал подается в ферментер. Процесс ферментации грибов для получения кормового рибофлавина длится 3 суток при температуре 28 — 30 °С. Концентрация рибофлавина в культуральной жидкости может достигать 1,4 мг/мл. По завершении процесса ферментации культуральную жидкость концентрируют в вакууме, высушивают на распылительной сушилке (влажность 5— 10%) и смешивают с наполнителями.
В 1983 г. во ВНИИ генетики микроорганизмов сконструирован рекомбинантный штамм продуцента Bacillus subtilis, характеризующийся увеличенной дозой оперонов, которые контролируют синтез рибофлавина. Клонированием генов рибофлавинового оперо- на в одной из созданных плазмид был получен производственный штамм-продуцент витамина В2, способный синтезировать втрое больше по сравнению с Е. ashbyii количество рибофлавина всего за 40 ч ферментации.
Получение витамина В12 (Соа[а-(5,6-диметилбензимидазолил)]- Сор — цианокобамид). Витамин В12 открыт в 1948 г. одновременно в США и Англии. В 1972 г. в Гарвардском университете был осуществлен химический синтез корриноидного предшественника витамина В12. Химический синтез корнестерона — структурного элемента корринового кольца витамина, включающий 37 стадий, в крупных масштабах не воспроизведен из-за сложности процесса.
Витамин В12 регулирует углеводный и липидный обмен, участвует в метаболизме незаменимых аминокислот, пуриновых и пири- мидиновых оснований, стимулирует образование предшественников гемоглобина в костном мозге; применяется в медицине для лечения злокачественной анемии, лучевой болезни, заболеваний печени, полиневрита и т. п. Добавление витамина к кормам способствует более полноценному усвоению растительных белков и повышает продуктивность сельскохозяйственных животных на 10 — 15 %.
тивирования на непрерывный процесс. В последние годы исследуется возможность получения витамина с использованием иммобилизованных клеток пропионовокислых бактерий.
Для нужд животноводства сотрудниками Института биохимии им. А. Н. Баха РАН разработана более простая и дешевая технология получения витамина В12, в создание которой большой вклад внесли работы В.Н.Букина, В.Я.Быховского, И.С.Логоткина, Е. С. Панцхавы и др.
По указанной технологии ферментацию осуществляет сложный биоценоз термофильных микроорганизмов, производящих метановое брожение. Комплекс микроорганизмов включает целлю- лозоразлагающие, углеводсбраживающие, аммонифицирующие, сульфитвосстанавливающие и метанообразующие бактерии. На первой фазе процесса (10 — 12 дней) развиваются термофильные углеводсбраживающие и аммонифицирующие бактерии. При этом в слабокислой среде (рН 5,0—7,0) органические соединения превращаются в жирные кислоты и аммиак. На второй фазе, когда среду подщелачивают до рН 8,5, в биоценозе преобладают метанообразующие бактерии, которые сбраживают возникающие на первой фазе продукты до метана и диоксида углерода. Именно метанообразующие бактерии — главные продуценты витамина. Обогащение сред очищенными культурами метанообразующих бактерий увеличивает выход активных форм витамина В12.
Источником углерода в питательной среде служит ацетонобути- ловая и спиртовая барда, которую представляют заводы, перерабатывающие зерно и мелассу. Для оптимизации питательной среды в нее добавляют соединения кобальта (хлорид кобальта — 4 г/м3), который входит в состав молекулы витамина В12, и субстраты для роста метанообразующих бактерий — низшие жирные кислоты и низшие спирты, что позволяет значительно повысить выход витамина.
Подготовленное сырье освобождают в декантаторе от взвешенных частиц и непрерывно подают в нижнюю часть ферментера (метантенка) емкостью 4200 м3. Одновременно в ферментер поступает посевной материал культуры микроорганизмов, предварительно выращенный в специальных аппаратах. Для выращивания продуцента требуются облигатно анаэробные условия, ибо даже следы кислорода подавляют рост бактерий. При создании анаэробных условий в среду подают диоксид углерода или газы, выделяющиеся в процессе ферментации. Ежедневно из метантенка отбирают 25 —30 % объема среды. Продукт ферментации стабилизируют, подкисляя соляной или фосфорной кислотой до рН 6,3 — 6,5 и добавляя 0,2 — 0,25 % сульфита натрия, что предотвращает разрушение витамина при тепловой обработке, особенно существенное в щелочной среде. В дальнейшем отобранная часть культуральной жидкости дегазируется, упаривается в вакууме; кон-
3.4.3. Производство органических кислот
В настоящее время биотехнологическими способами в промышленных масштабах синтезируют ряд органических кислот. Из них лимонную, глюконовую, кетоглюконовую и итаконовую кислоты получают лишь микробиологическим способом, молочную, салициловую и уксусную — как химическим, так и микробиологическим способами, а яблочную — химическим и энзиматическим путем.
Получение уксусной кислоты. Уксусная кислота имеет наиболее важное значение среди всех органических кислот. Ее используют при выработке многих химических веществ, включая каучук, пластмассы, волокна, инсектициды. Микробиологический способ получения уксусной кислоты состоит в конверсии этанола в уксусную кислоту при участии бактерий штаммов Acetobacter и Gluconobacter:
Алкогольдегидрогеназа Альдегиддегидрогеназа
+НАД+ +НАД++Н20
СН3СН2ОН СНзСНО ——----- ^СНзСООН
Этанол ~НАДН+Н -НАДН+Н+ уксусн£Ш
кислота
Процесс идет в анаэробных условиях в режиме непрерывного культивирования продуцента. Для роста бактерии Acetobacter aceti используют питательные среды, содержащие 6 — 12% этилового спирта, 1 % бактериального гидролизата, 0,05 % дигидрофосфата калия, 0,1% гидрофосфата аммония и 0,05% сульфата магния. Максимальная удельная активность непрерывной культуры A. aceti (количество микрограммов субстрата, подвергшегося окислению 1мкг биомассы за 1 мин) достигается к 20-м суткам культивирования при концентрации спирта 7 % и составляет 3,0 ед./мг.
Получение лимонной кислоты. Лимонную кислоту широко используют в пищевой, фармацевтической и косметической промышленности. Ею заменяют фосфаты в составе детергентов, так как она полностью метаболизируется живыми организмами. Лимонная кислота образует хелаты с металлами, поэтому ее применяют для их очистки. Объем мирового производства цитрата составляет 400 тыс. т/год. Самый крупный производитель лимонной кислоты — США. Производство лимонной кислоты принадлежит к числу старейших промышленных микробиологических процессов: оно было организовано в 1893 г. С этого момента параллельно развитию фундаментальной микробиологии велись изыскания оптимальных продуцентов и технологических вариантов процесса ферментации.
Для промышленного производства лимонной кислоты используют главным образом культуру гриба Aspergillus niger, а также A. wentii.
Метаболическим источником лимонной кислоты в организме служит цикл трикарбоновых кислот — составная часть цикла Креб-
са. Суммарное уравнение химических процессов этого цикла следующее:
СН3С ~ SKoA + ЗНАД+ + ФАД + ГДФ + Н3Р04 +4Н20 —- О
— 2СОг + ЗНАДН + ЗН++ ФАДН2 + ГТФ + HSKoA
| Глюкоза |
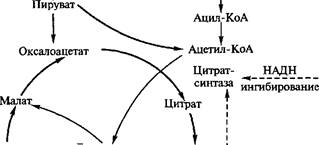
Реакция образования лимонной кислоты, катализируемая цит- ратсинтазой, открывает цикл Кребса, в котором цитрат постепенно окисляется до щавелево-уксусной кислоты (ЩУК). ЩУК снова конденсируется с ацетил-КоА, так что вновь образуется лимонная кислота (рис. 3.5). Цитратсинтаза определяет скорость реакций, составляющих цикл Кребса. Активность фермента зависит от концентрации ЩУК, содержание которой может поддерживаться за счет функционирования конститутивной пируваткар- боксилазы, обеспечивающей переключение в аэробных условиях процессов гликолиза и глиоксилевого цикла. Активность цитрат-
н-Алканы (С9—С30)
I
Фруктозо-6-фосфат
| Алифатические спирты I |
I
Фруктозо-1,6-дифосфат
|
| 3-Фосфоглицериновый |
| 1ИН0ВЫЙ |
| Алифатические кислоты |
| Фумарат 1 лиоксилат -«— Изошггоат |
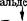
|
 Сукцинил-КоА-
ингибирование
Рис. 3.5. Схема биосинтеза лимонной кислоты
Сукцинил-КоА-
ингибирование
Рис. 3.5. Схема биосинтеза лимонной кислоты
|
синтазы тормозится НАДН и сукцинил-КоА. Скорость оборота цикла Кребса определяется поддержанием необходимого уровня окисленных форм коферментов дегидрогеназ (НАД+ и ФАД; см. уравнение реакции), поэтому высокий выход цитрата получается лишь при условии хорошей аэрации. Накопление в культуральной среде существенных количеств цитрата — промежуточного соединения цикла Кребса — невыгодно для организма и является следствием дисбаланса метаболизма или нарушения его генетической природы. Рост культуры грибов обычно регулируют путем изменения содержания фосфата, ионов марганца, железа и цинка в среде. Дефицит фосфата ведет к сверхпродукции цитрата. Роль ионов металлов не до конца установлена. Считают, что дефицит ионов металлов влияет на свойства клеточных мембран и морфологию гиф.
Процесс ферментации, ведущий к образованию лимонной кислоты, проводят при низких значениях рН (3—4), что облегчает поддержание стерильных условий ферментации и уменьшает возможность образования побочных продуктов. В более щелочной среде происходит накопление щавелевой и глюконовой кислот. Предполагают, что в кислой среде стимулируется гликолиз, что обеспечивает направление потока углерода в цикл Кребса.
Питательные среды для культивирования продуцентов лимонной кислоты в качестве источника углерода содержат дешевое углеводное сырье: мелассу, крахмал и глюкозный сироп. Гриб A. niger чаще всего выращивают на мелассе. Гриб Trichoderma viride синтезирует значительные количества цитрата из глюкозы, что позволяет использовать для этого процесса целлюлозу. Предложены штаммы бактерий (Corynebacterium, Arthrobacterium и Brevibacterium) и дрожжей рода Candida, осуществляющие процесс на основе н-парафинов (С9—С30), которые пока широко не внедрены в промышленность.
Существует несколько технологических вариантов промышленного производства лимонной кислоты. Первоначально был разработан вариант процесса, основывающийся на поверхностной ферментации, позднее — на глубинном культивировании. Последнее ведется в две стадии: на первой стадии идет рост мицелия, а на второй, после выхода культуры в стационарную фазу — интенсивный синтез лимонной кислоты. В конце ферментации массу мицелия отделяют путем фильтрования и промывают. Затем при рН < 3,0 в виде кальциевой соли осаждают щавелевую кислоту, а из маточного раствора выделяют лимонную кислоту в форме средней соли, кристаллизующейся в комплексе с четырьмя молекулами воды. Свободную кислоту выделяют из промытых кристаллов соли после их обработки сульфатом кальция. Высокоочищенные препараты лимонной кислоты получают после дополнительной процедуры очистки методом ионообменной хроматографии. Выход продукта составляет 85 %.
С 20-х годов XX в. налажено промышленное производство D- глюконовой кислоты из глюкозы при участии A. niger. При этом за 48 ч ферментации культуры гриба степень превращения субстрата составляет 90 %. Глюконат натрия, в виде которого обычно выделяют глюконовую кислоту, используют для извлечения металлов, борьбы со ржавчиной, как моющее средство и в качестве медицинского препарата. С участием культуры грибов из рода Aspergillus путем ферментации глюкозы получают с высоким выходом ита- коновую кислоту, использующуюся для производства пластмасс и красителей.
Новые возможности для интенсификации производственных процессов получения органических кислот открывает применение иммобилизованных ферментов и клеток микроорганизмов.
3.5. БИОТЕХНОЛОГИЯ ПОЛУЧЕНИЯ ВТОРИЧНЫХ МЕТАБОЛИТОВ
Принципы получения вторичных метаболитов основаны на особенностях их образования клетками микроорганизмов. Биосинтез вторичных метаболитов фазоспецифичен и происходит по завершении стадии роста, в идиофазе, благодаря чему их еще называют идиолитами (см. с. 32). Среди вторичных метаболитов ведущее место по объему производства занимают антибиотики.
3.5.1. Получение антибиотиков
В мире ежегодно производится антибиотиков почти на 20 млрд долларов. К числу антибиотиков относятся важнейшие противо- микробные и противоопухолевые препараты. Открытие антибиотиков произвело переворот в лечении инфекционных заболеваний. Ушли в прошлое представления о неизлечимости многих бактериальных инфекций (туберкулез, сепсис, сифилис и др.). Антибиотики применяют в ряде отраслей народного хозяйства (растениеводство, животноводство, ветеринария, пищевая промышленность и др.), где они используются более широко, чем в медицине. Организация крупномасштабного производства антибиотиков сыграла решающую роль в становлении промышленной биотехнологии.
К антибиотикам относятся низкомолекулярные эффекторы изначально природного происхождения, способные подавлять рост живых клеток. Антибиотики, продуцируемые растительными объектами, называют фитонцидами. Вопрос о физиологических функциях антибиотиков, их месте в метаболизме и процессах эволюции окончательно не решен. Антибиотики возникли в борьбе за существование почвенных биоценозов, поэтому многие из них
служат средствами нападения и защиты, т. е. представляют собой своеобразное химическое «оружие» клетки. Однако эти функции у антибиотиков не единственны. Известно, что они могут участвовать в процессах детоксикации вредных метаболитов, контролировать некоторые стороны обмена веществ и целые процессы развития, например дифференцировку клеток, служить запасными питательными веществами. Некоторые исследователи рассматривают антибиотики как случайные вещества, обладающие полезными свойствами, другие считают их реликтовыми молекулами, вытесненными в ходе эволюции продуктами рибосомального синтеза, но и до сих пор сохранившими способность вмешиваться в биохимические процессы.
Способность нитчатого гриба зеленой плесени Penicillium notatum вызывать гибель микроорганизмов впервые была установлена в 1928 г. английским микробиологом А. Флеммингом. Однако лечебные свойства этой плесени были описаны еще в 1871 г. русским дерматологом А. Г. Полотебновым. Количество открываемых антибиотиков постоянно растет. В 1940 г. было известно всего 6 антибиотиков, а в настоящее время описано более 12 000 аналогичных соединений, из которых в клинике применяют около 200 препаратов. 97 % известных антибиотиков токсичны, поэтому в практике не используются. В химическом отношении они представляют сборную группу органических веществ. В зависимости от химической природы и ряда других свойств известные антибиотики делят на ряд классов:
1. Р-Лактамные (пенициллины, цефалоспорины) составляют более 50 % рынка антибиотиков.
2. Тетрациклины (тетрациклин, морфоциклин, метациклин).
3. Макролиды (эритромицин, олеандомицин).
4. Аминогликозиды (гентамицин, амикацин).
5. Гликопептиды (ванкомицин, ристомицин).
6. Амфениколы (левомицетин).
7. Линкосамиды (линкомицин).
8. Полиеновые [противогрибковые (нистатин, леворин)].
9. Противоопухолевые (блеомицин) и др.
Большой вклад в установление структуры ряда антибиотиков внесли М. М. Шемякин, Ю. А. Овчинников, В. Т. Иванов, А. С. Хохлов, Г.Б.Локшин, М.Н.Колосов, Ю.А.Берлин, Е.С. Есипов, А.Д. Кузовнов.
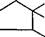
Химические формулы наиболее распространенных антибиотиков следующие:
S
|
| СН2—СО—NH |
| СН3 СООН |
| 0=С N |
О
Бензилпенициллин
но^ сн,
| 6нТ conh2 он о он о |
| -СН(ОН)-СН-СН2ОН сн |
| 0,N |

| Стрептомицин |
лш
ЛЛ
Левомицетин
D—фен —про — вал —орн — лей / \ лей— орн — вал — про — D — фен
| NH II NH-C-NH, |

| NH |
| H,N—С—N |
| HN-CO-CHC1, |
| ОН |
| л = СН2ОН у = CH3NH |

| Тетрациклин |
Грамицидин
По типу действия антибиотики делят на бактерицидные (лак- тамные, аминогликозиды), вызывающие гибель микроорганизмов, и бактериостатические (макролиды, тетрациклины, левомицетин), нарушающие способность микроорганизмов делиться. По спектру действия различают антибиотики узкого и широкого действия. К последним относят тетрациклины, макролиды, аминогликозиды, которые особенно полезны в случае неидентифицированных возбудителей болезни, однако при длительном применении они вызывают у пациентов дисбактериоз.
В последние годы достигнуты большие успехи в расшифровке молекулярного механизма действия антибиотиков. Наиболее яркая особеннность антибиотиков — исключительная специфичность их действия. По выражению П. Эрлиха, антибиотики — это магические пули. Специфика действия их состоит в избирательном подавлении этими эффекторами одного или нескольких процессов лишь у некоторых микроорганизмов. Таким образом, антибиотики блокируют метаболические мишени в клетках-мишенях. В зависимости от специфики действия антибиотиков на молекулярном уровне различают следующие группы соединений, вызывающие у бактерий:
1) нарушение биосинтеза пептидогликанов клеточной стенки (пенициллины, ванкомицин, цефалоспорины);
2) нарушение отдельных этапов процессов трансляции (амфени- колы, аминогликозиды, тетрациклины, макролиды, линкосамиды);
3) повреждения цитоплазматической мембраны (грамицидин, полимиксины);
4) нарушение биосинтеза нуклеиновых кислот (рифамицины, актиномицин D, противоопухолевые антибиотики);
5) нарушение энергетического обмена (олигомицин, хлоргек- сидин).
Антибиотики широко используют в качестве молекулярных инструментов при исследовании фундаментальных проблем биологии, таких, как расшифровка тончайших механизмов биосинтеза белка, нуклеиновых кислот и структуры клеточных стенок бактерий, создание моделей транспорта ионов через биологические мембраны и др.
Изыскание новых антибиотиков обусловлено как потребностями практики, так и накоплением резистентных форм микроорганизмов по отношению ко многим антибиотикам. Устойчивость бактерий к пенициллинам и цефалоспоринам создает присутствующий в их клетках энзим лактамаза (пенициллиназа). Фермент гидролизует амидную связь (3-лактамного цикла в молекуле антибиотика с образованием пенициллиновой кислоты, которая полностью лишена антимикробной активности:
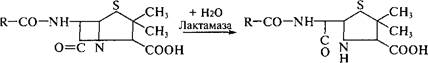
|
| О Н Пенициллиновая кислота |
| Пенициллин |
Специальное изучение объема и потенциала защитных свойств микроорганизмов показало, что их резистентность к антибиотикам имеет глобальный характер и обеспечивается как разнообразием фенотипов резистентности, так и разнообразием и стабильностью систем горизонтального генного транспорта. Поэтому главное направление получения новых антибиотиков состоит не в открытии новых соединений, а в химической трансформации природных молекул для создания полусинтетических антибиотиков, характеризующихся значительно меньшей резистентностью и токсичностью, но более широким спектром действия, большим временем жизни, химической и биологической устойчивостью. Важный подход на пути получения устойчивых аналогов антибиотиков — использование природных ингибиторов (3-лактамаз — кла- вулановой и оливановой кислот.
Методы получения антибиотиков путем химического синтеза чрезвычайно сложны и не могут конкурировать с их биосинтезом методами биотехнологии. Существует несколько способов получения как природных, так и полусинтетических антибиотиков. Направленный биосинтез антибиотиков осуществляется путем прямой ферментации микроорганизма — продуцента с подходящим
нии природы его ацильнои группировки при сохранении в неизменном виде ядра пенициллина — 6-аминопенициллановой кислоты (6-АПК). В промышленности 6-АПК получают путем гидролиза природных пенициллинов с помощью специфического фермента — пенициллинацилазы, образующейся с высоким выходом в процессе ферментации ряда штаммов микроорганизмов. Аци- лазы различают по их субстратной специфичности. Некоторые из ацилаз способны катализировать и обратные реакции — процессы ацилирования аминогруппы 6-АПК с образованием модифицированного пенициллина. Таким путем было получено более 40 ООО полусинтетических пенициллинов. Существенно, что во многих случаях 6-АПК не выделяют из культуральной жидкости, например при превращении бензилпенициллина в ампициллин:
| сн3 сн3 соон |
| а |

| ch,-co-nh- |
0=с n Бензилпенициллин
|
| сн,-соон |
+ Н20, пенициллин- ацилаза

| n 6-АПК |
| h2n- 0=С |
сн3 сн3 соон
Бензилпенициллин гидролизуют ацилазой мутанта Kluyvera citrophi- la при рН 7,8 — 8,0 и температуре 40—50 "С. Затем в ферментер вносят мутант Pseudomonas melanogenum и фенилглицин. Условия ферментации изменяют таким образом (рН 5,0 — 5,5), чтобы ацилаза второго мутантного организма осуществляла синтез ампициллина:
Дата добавления: 2016-02-09; просмотров: 1257;
