БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ 14 страница
Сомаклональные вариации нельзя рассматривать как случайные спонтанно возникающие мутации. Генетические изменения, характерные для сомаклональных вариаций, сложны и носят комплексный характер. Частота таких генетических изменений на три порядка превышает частоту спонтанных мутаций. Кроме того, сомаклональные варианты отличаются от исходного растения не только качественными моногенными признаками, но и количественными — полигенными (интенсивность роста, продуктивность, устойчивость к неблагоприятным факторам внешней среды).
Отмечены случаи появления сомаклональных вариантов, сочетающих признаки, которые невозможно или трудно соединить в одном генотипе традиционным селекционным путем. Так, Л.А.Кучеренко (1986) выделила из сомаклональных вариантов, возникших в каллусной культуре риса, растения, сочетавшие скороспелость и длиннозерность. На их основе за короткий срок был. создан новый сорт риса.
По-разному сказываются на генетических изменениях и, следовательно, на появлении сомаклональных вариаций различные типы морфогенеза. Экспериментально установлено, что при соматическом эмбриогенезе цикл «клетка — растение» совершается значительно быстрее, чем при органогенезе. Поэтому степень различия между полученным и исходным родительским генотипом в случае органогенеза может быть значительно выше, чем при эмбриогенезе.
Источником генетического разнообразия растительного материала могут быть не только сомаклональные вариации, но и мутагенез, в несколько раз повышающий образование стабильно устойчивых по искомым признакам клонов клеток.
После получения различных сомаклональных вариаций от исходного растения наступает следующий этап — отбор необходимых сочетаний признаков. Данный вопрос решается с помощью клеточной селекции, которую проводят практически на любом объекте, введенном в культуру in vitro. Однако удобнее использовать суспензионную культуру или изолированные протопласты. Преимущество этих объектов состоит в быстром росте культуры и равномерном действии селективного фактора на все клетки. Для отбора сомаклональных вариаций соответствующие селективные факторы (соли в высоких концентрациях, гербициды и др.) добавляют в питательную среду для выращивания культуры клеток либо растущие культуры помещают в селективные условия (низкая или высокая температура, освещенность и т.д.). Существует несколько методов клеточной селекции:
1. Прямая (позитивная) селекция, при которой выживает только заданный тип мутантных клеток.
2. Непрямая (негативная) селекция, которая ведет к гибели делящихся клеток дикого типа и выживанию метаболически неактивных клеток. Этот прием требует дополнительной идентификации мутационных изменений у выживших клеток.
3. Тотальная селекция, при которой индивидуально тестируются все клеточные клоны.
4. Визуальная селекция и неселективный отбор, когда необходимая вариантная линия выбирается среди прочих визуально или с помощью биохимических методов.
Для отбора клеток, устойчивых к неблагоприятным или стрессовым факторам, наиболее часто применяют прямую селекцию. После выбора нужной популяции необходимо проверить стабильность устойчивости к неблагоприятному фактору. Это длительный процесс, включающий многочисленные циклы выращивания и пересадки клеток на среды, содержащие селективный фактор или без него. Из стабильных клонов необходимо попытаться регенерировать растения. Получение растений-регенерантов, а также гибридологический анализ подтверждают генетическую природу при-
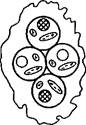
заряд, который вызывает их взаимное отталкивание. Для слияния это отталкивание необходимо преодолеть специальными приемами, способствующими снятию или перераспределению поверхностного заряда мембран. Впервые искусственное слияние протопластов с помощью индуктора слияния (фьюзогена) было осуществлено в 1970 г. Коккингом и его сотрудниками. В настоящее время в качестве эффективных фьюзогенов используют полиэти- ленгликоль (ПЭГ) и растворы с рН 9—11 и высокой концентрацией ионов кальция. Согласно одной из гипотез, объясняющих слияние протопластов при использовании ПЭГ, высокая концентрация этого вещества (20—30 %) способствует поглощению всей свободной воды между протопластами, вызывая их слипание в результате дегидратации. Кроме того, поглощение свободной воды индуцирует образование пор в мембране, через которые перетекает внутриклеточное содержимое. Если повреждения мембран обратимы, слипшиеся протопласты регенерируют клеточную стенку (рис. 6.7).
|

|
|
| Рис. 6.7. Схема слияния протопластов под действием полиэтиленгликоля (по X. Борнман, 1991): 1 — изолированные протопласты; 2— слипание протопластов в результате дегидратации; 3 — образование пор в мембране протопласта; 4 — перетекание через поры внутриклеточного материала; 5 — гибридный протопласт |
Кроме того, существует физический фактор — импульсы электрического тока, который также заставляет протопласты сливаться. Обработка электрическими импульсами, как и обработка ПЭГ, приводит к обратимому повреждению мембран. Применение переменного тока вызывает диэлектрофорез, и протопласты, находящиеся между электродами, выстраиваются в ряд, примыкая друг к другу своими полярными поверхностями. Импульс постоянного
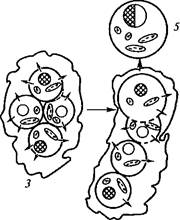
тока приводит к образованию пор, через которые происходит слияние (рис. 6.8).
При соматической гибридизации развиваются клетки двух типов: гибриды и цибриды. При образовании гибридов объединяется ядерный геном обеих клеток. Цибридная клетка содержит цитоплазму обоих партнеров, а ядро — одного. Такой результат достигается при деградации одного из ядер после слияния или в том случае, если один из протопластов был лишен ядра.
Первый неполовой гибрид высших растений был получен в 1972 г. при слиянии изолированных протопластов двух видов табака: Nicotiana glauca и Nicotiana langsdorfii. В настоящее время получено много межвидовых, межсемейственных и межтрибных гибридов, значительную часть которых нельзя считать нормальными растениями, а некоторые гибриды (гибрид арабидопсиса и турнепса) представляют собой растения-монстры. Возникающие аномалии — результат хромосомной несбалансированности. Описаны случаи возникновения гибридов между протопластами эритроцитов крысы и дрожжевых клеток, моркови и человека и др. Любые исследования, любые манипуляции в области создания новых генотипов должны быть тщательно и всесторонне продуманы, а ученые должны помнить об ответственности и научной этике. Профессор Колумбийского университета Э. Чаргафф предупреждал о том, что «в тысяче опытов, вероятно, ничего не случится,
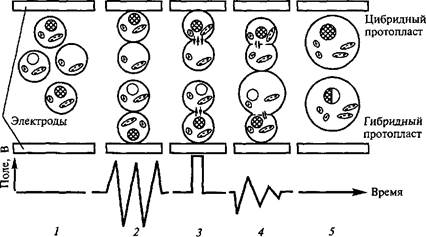 Рис. 6.8. Схема слипания протопластов под действием электрического поля (по Х.Борнман, 1991):
/ — изолированные протопласты; 2 — слипание протопластов полярными поверхностями; 3 — образование пор в мембранах под действием сильного импульса постоянного тока; 4 —смешивание цитоплазмы; 5 — образование цибридных (гибридных) протопластов
Рис. 6.8. Схема слипания протопластов под действием электрического поля (по Х.Борнман, 1991):
/ — изолированные протопласты; 2 — слипание протопластов полярными поверхностями; 3 — образование пор в мембранах под действием сильного импульса постоянного тока; 4 —смешивание цитоплазмы; 5 — образование цибридных (гибридных) протопластов
|
hq затем в одном каком-то случае произойдет нечто очень неприятное». Он был «убежден, что именно попытка преобразовать или перехитрить природу почти привела к ее гибели».
Введение в протопласты макромолекул, клеточных органелл и бактериальных клеток. Чужеродный генетический материал можно переносить в клетку не только при соматической гибридизации, но и при непосредственном введении ДНК или органелл, содержащих ДНК, в изолированные протопласты. Работы в этом направлении начаты не так давно, но уже получены интересные результаты. Так, поглощение экзогенных макромолекул ДНК показано у протопластов петунии, сои, моркови. Проведена трансплантация органелл (ядер, митохондрий, хлоропластов) в протопласты растений. Наибольшую важность представляют опыты по трансплантации хлоропластов одних растений в клетки других. П.Карлсон провел опыты по введению хлоропластов нормального зеленого растения Nicotiana suaveolens в протопласты пестролистного мутанта N. tabacum. В результате культивирования протопластов были получены зеленые каллусы, из которых регенерировали растение, оказавшееся пестролистным. Для того чтобы понять, содержит растение-регенерант элементы геномов двух видов Табаков или только одного, проанализировали белковую фракцию I, в которую входит ключевой фермент цикла Кальвина — рибулозодифосфаткарбоксилаза (РДФ-карбоксилаза). Этот фермент состоит из двух больших субъединиц и двух малых. Большие субъединицы кодируются геномом хлоропластов, малые — ядерными генами. Анализ состава белковой фракции I растения- регенеранта показал присутствие полипептидов, характерных и для пластид N. tabacum, и для пластид N. suaveolens. Перспективность работ по трансплантации хлоропластов заключается в том, что введение высокоэффективных хлоропластов может способствовать активации фотосинтеза и повышению продуктивности других растений.
Среди бактериальных клеток к созданию искусственных ассоциаций с растительными клетками наиболее способны цианобак- терии. Это может быть связано с тем, что они часто вступают в симбиотические отношения с другими организмами; что древние цианобактерии, вероятно, участвовали в формировании растительных клеток в процессе эволюции; что цианобактерии способны выделять в среду разнообразные вещества: углеводы, аминокислоты, вещества гормональной природы и другие, которые могут быть использованы культивируемыми клетками растений. Растительные клетки способны потреблять кислород, образующийся в процессе фотосинтеза цианобактерий, а цианобактерии потребляют диоксид углерода, выделяемый растительными клетками при дыхании. Кроме того, азотфиксирующие цианобактерии могут накапливать азот в почве и обеспечивать до 15 % потребностей растений в нем. Например, симбиоз папоротника Azolla с Anabaena azollae применяют в сельском хозяйстве в качестве источника связанного азота на рисовых полях.
Большой интерес вызывает тот факт, что цианобактерии могут выступать в качестве фототрофного компонента ассоциаций с растительными клетками. Использование питательных сред, в которых не хватает источника углерода, показало, что прирост растительных клеток может быть обеспечен за счет усвоения ими продуктов фотосинтеза цианобактерий или их лизиса. Однако не все сочетания растений и цианобактерий оказывают взаимное благотворное влияние. Выявлена видовая специфичность взаимодействия партнеров. Так, клетки культуры мака и Anabaena variabilis взаимно подавляли рост друг друга. В то же время на рост культивируемых клеток табака, женьшеня, диоскореи цианобактерии оказывали стимулирующее влияние. В большинстве случаев существенное влияние одного партнера на ростовые процессы другого не выявлялось.
Совместное выращивание растительных клеток и цианобактерий имеет еще одну важную особенность. На дефицитной среде оно может приводить к увеличению синтеза вторичных метаболитов по сравнению с их накоплением в монокультуре на полной среде.
Введение азотфиксирующих цианобактерий в культуру растительных клеток могло бы наряду с применением методов генной инженерии решить проблему азотфиксации. Показано, что в смешанных культурах каллуса табака и цианобактерий на среде Му- расиге и Скуга формировались побеги регенерантов табака с участками сине-зеленого цвета, где локализовались цианобактерии. Вероятно, большие межклетники в каллусах табака способствуют проникновению цианобактерий сначала в межклетники каллусной ткани и в область меристемоидов, а затем — в формирующиеся побеги. Цианобактерии сохранялись на поверхности и в тканях стебля и листьев при многочисленных пересадках, образовании вторичных каллусов и последующей регенерации из них побегов, т. е. образовывалась устойчивая ассоциация растительной и бактериальной клетки. Азотфиксирующие цианобактерии обеспечивали рост растительных клеток в суспензионных и каллусных смешанных культурах на питательных средах, дефицитных по азоту, а в ассоциациях с растениями — и в песчаной культуре, не содержащей связанного азота. Это действие обеспечивается, по- видимому, за счет продуктов азотфиксации, выделяющихся в среду. В свою очередь, цианобактерии могут получать от растений углеводы. Причем цианобактерии, предварительно культивируемые с растительными клетками, получают от побегов в 2,5 раза больше меченых соединений углерода по сравнению с цианобактериями, взятыми из чистой культуры. В результате такого потребления растение-хозяин может значительно снизить интенсивность собственных ростовых процессов. Поэтому прежде чем приступить к практическому использованию искусственных ассоциаций, необходимо решить проблему обеспечения азотфиксирующего симбионта органическими веществами без нанесения существенного ущерба растению.
6.8.3. Клональное микроразмножение и оздоровление растений
Клональным микроразмножением называют неполовое размножение растений с помощью метода культуры тканей, позволяющее получать растения идентичные исходному. В основе получения таких растений лежит способность соматических клеток растений полностью реализовывать свой потенциал развития, т.е. свойство тотипотентности. Метод клонального микроразмножения получает все более широкое распространение во всем мире. В большинстве стран эта технология приобрела коммерческий характер.
В России первые работы по клональному микроразмножению были проведены в 60-х годах XX в. в лаборатории Р. Г. Бутенко (Институт физиологии растений им. К.А.Тимирязева). В настоящее время созданы и развиваются лаборатории клонального микроразмножения, связанные с нуждами селекции, размножением декоративных, лекарственных и других растений. Кроме того, технология используется для размножения лучших экземпляров взрослых лесных деревьев, особенно хвойных, для сохранения редких и исчезающих видов растений.
Свое название эта технология размножения получила от термина «клон» (от греч. clon — отпрыск), который предложил Веб- бер в 1903 г. Клональное микроразмножение имеет существенные преимущества перед традиционными способами размножения:
1. Высокий коэффициент размножения. Одно растение герберы за год при микроклональном размножении дает до 1 млн новых растений, тогда как при обычных способах размножения — только 50 — 100 растений. Большинство культивируемых в настоящее время сортов лилий размножается только вегетативно. Луковички возникают на материнских луковицах или на побеге в небольших количествах. Технология микроклонального размножения позволяет получить из одной чешуи луковицы за 6 месяцев 105 новых растений (сорт Red Carpet).
2. Получение генетически однородного посадочного материала.
3. Возможность оздоровления растений, освобождения их от вирусов благодаря клонированию меристематических тканей.
4. Возможность размножения растений, которые в естественных условиях репродуцируются с большим трудом.
5. Воспроизведение посадочного материала круглый год, что значительно экономит площади, занимаемые маточными и размножаемыми растениями.
6. Сокращение продолжительности селекционного периода, ускорение перехода растений от ювенильной фазы развития к репродуктивной.
Технология микроклонального размножения. Обязательное условие клонального микроразмножения — использование объектов, полностью сохраняющих генетическую стабильность на всех этапах процесса, от экспланта до растений в поле. Такому требованию удовлетворяют апексы и пазушные почки органов стеблевого происхождения, т. е. меристематические ткани. Их устойчивость к генетическим изменениям, вероятно, связана с высокой активностью систем репарации ДНК, а также с негативной селекцией измененных клеток.
Процесс клонального микроразмножения можно подразделить на 3 этапа:
1. Получение хорошо растущей стерильной культуры. На этом этапе необходимо правильно выбрать растение-донор, получить свободную от инфекции культуру, добиться ее выживания и быстрого роста на питательной среде.
2. Собственно размножение, осуществляемое несколькими способами:
активизация пазушных меристем;
индукция образования адвентивных почек тканями листа, стебля, чешуйками и донцем луковиц, корневищем и зачатками соцветий без первоначального образования каллусной ткани;
микрочеренкование побега, сохраняющего апикальное доминирование;
стимуляция образования микроклубней и микролуковичек;
индукция соматического эмбриогенеза.
3. Подготовка к высадке в поле или к реализации. Это очень важный этап, во время которого в теплице укорененные растения, полученные in vitro, адаптируют к новым условиям внешней среды: проводят закаливание растений, повышают их устойчивость к патогенным микроорганизмам и различным неблагоприятным факторам внешней среды. Существует много различных способов адаптирования растений к пересадке in vivo. Это подбор почвенного субстрата, создание определенной влажности, обработка химическими веществами (глицерин, парафин) для предотвращения обезвоживания листьев. Некоторые древесные растения лучше приживаются, если их заразить in vitro микоризооб- разующими грибами (Е.А.Калашникова, 1993). Упрощенный способ адаптации пробирочных растений винограда был разработан в Институте физиологии растений им. К. А. Тимирязева РАН. Адаптацию проводят прямо в пробирках, снимая с них пробки, когда растения винограда дорастают до верха пробирки. Через 1,5 — 2 недели, когда верхушки побега с двумя развитыми листьями появляются над пробиркой, растение готово к пересадке в почву.
Для предотвращения механических повреждений корневой системы растение пересаживают в почву вместе с агаром, заглубляя его так, что над поверхностью почвы остаются только 2 развитых листа, которые выросли из пробирки и уже адаптировались к внешним условиям. Такая методика позволяет значительно упростить, ускорить и удешевить этап акклиматизации растений.
Клональное микроразмножение растений проводят разными способами. Первый и основной способ — активизация пазушных меристем. Он состоит в снятии апикального доминирования и активизации развития меристем, существующих в растении. Этот способ основной и в обычном вегетативном размножении. И на интактном растении, и в случае клонирования снятие апикального доминирования достигается или удалением апикальной меристемы побега, или благодаря действию цитокинина. При клонировании цитокинины (6-бензиламинопурин, 6-фурфуриламино- пурин, зеатин) добавляют в питательную среду, что приводит к развитию многочисленных пазушных побегов. Эти побеги отделяют от первичного экспланта и культивируют на свежей питательной среде. Активизацию пазушных меристем широко используют в промышленном размножении овощных сельскохозяйственных культур (картофель, томаты, огурцы, сахарная свекла, топинамбур и др.), цветов (гвоздика, роза, гербера), плодовых и ягодных культур (яблоня, вишня, малина, крыжовник и др.), древесных растений (туя, можжевельник и др.). Однако бесконечно размножать таким способом растения нельзя, поскольку длительное воздействие цитокининов, входящих в состав питательных сред, вызывает аномалии в морфологии стебля, потерю способности побегов к укоренению, иногда — гибель растений. В опытах с размножением земляники было показано, что при клонировании необходимо чередовать 2 — 3 цикла получения побегов с их укоренением.
Второй способ — индукция развития адвентивных почек, т. е. почек, возникающих из растительных клеток и тканей, которые их обычно не образуют. Этот метод в значительной мере обусловлен тотипотентностью клеток. Почти любой орган или ткань растения, свободные от инфекции, могут быть использованы в качестве экспланта и в определенных условиях образуют адвентивные почки. Данный процесс вызывают внесением в питательную среду определенных концентраций цитокининов и ауксинов, причем цитокинина должно быть гораздо больше, чем ауксина. Это наиболее распространенный способ микроразмножения высших растений. Развивая адвентивные почки на апикальных и пазушных меристемах, размножают растения томата, лука, чеснока; на сегментах листовых пластинок — салат, глоксинию, фиалки; на тканях донца луковиц — лук, чеснок, гладиолусы, тюльпаны и другие луковичные растения.
1 ПС
Факторы, влияющие на клональное микроразмножение. Питательная среда. Состав питательной среды — один из наиболее важных факторов при микроразмножении. Обычно используют стандартные среды: Мурасиге-Скуга, Нича и др., но с добавлением на каждом этапе различных веществ. На первом этапе в питательную среду часто вносят антиоксиданты, чтобы предотвратить гибель клеток из-за активизации гидролитических ферментов. Особое значение имеют концентрация и соотношение фитогормонов в среде. Например, на втором этапе для усиления морфогенеза обычно добавляют цитокинины. Напротив, на третьем этапе при укоренении в питательной среде должно быть только небольшое количество ауксинов (либо используется безгормональная среда). Иногда в среду добавляют гиббереллин (ГК), который стимулирует рост сформировавшихся почек. Важным регуляторным фактором служит сахароза. Обычная концентрация ее в среде составляет 3 %. На растениях каперса было показано, что более высокая концентрация сахарозы в среде приводила к образованию пурпурных, содержащих антоциан, почек возобновления. При концентрациях сахарозы менее 3 % наблюдалось формирование зеленых почек, способных к размножению.
Кроме того, существенное значение имеет состояние среды. Например, культивирование меристем земляники, вишни, черной смородины лучше происходит в жидкой питательной среде, чем в агаризованной.
Состояние экспланта. Морфогенез в значительной мере определяется возрастом и размером экспланта. Так, у эхеверии эксплантат из молодых листьев образуют корни, из старых листьев — побеги. И только у листьев среднего возраста возникают и побеги, и корни, т.е. появляется возможность регенерации целого растения. Размер экспланта прямо пропорционально связан с регенера- ционной способностью: чем крупнее эксплант, тем выше эта способность. Большие экспланты могут самопроизвольно независимо от соотношения в питательной среде ауксинов и цитокининов образовывать почки. Но увеличение размера может привести к негативным последствиям, так как появляется вероятность присутствия в экспланте клеток, содержащих вирусную, грибковую и другие виды инфекции. Оптимальная величина экспланта должна обеспечивать как активный морфогенез, так и полную стерильность.
На регенерационную способность экспланта влияют также физиологическое состояние и таксономическая принадлежность растения-донора. Например, экспланты, выделенные из растений в фазу покоя, обладают более низкой способностью к укоренению и развитию побегов по сравнению с эксплантами, изолированными в фазу активного роста. Двудольные травянистые растения характеризуются большей регенерационной способностью, чем однодольные.
Чем больше размер экспланта, тем легче идет морфогенез, в результате которого получается целое растение, но тем больше вероятность присутствия вирусов в экспланте. У многих видов и сортов растений зона, свободная от вирусных частиц, различна. Так, при клонировании апикальной меристемы картофеля размером 0,2 мм (конус нарастания с одним листовым зачатком) 70 % полученных растений были свободны от Y-вируса картофеля, но только 10 % — от Х-вируса. В некоторых случаях не удается найти оптимальное соотношение между размером меристематического экспланта и морфогенезом в нем, и при этом избавиться от вирусной инфекции. Приходится дополнять метод культуры меристем термо- или(и) хемитерапией. Так, предварительная термотерапия исходных растений позволяет получать свободные от вирусов растения-регенеранты из меристемных эксплантов размером от 0,3 мм до 0,8 мм. Вместе с тем этот прием может вызвать отставание растений в росте, деформацию органов, увеличение латентных (скрытых) инфекций.
Хорошие результаты дает совместное применение метода культуры тканей и хемитерапии. При внесении в питательную среду препарата «Вирозол» (1-рибофуранозил-1,2,4-триазолкарбоксамид) количество безвирусных растений увеличивается до 80 — 100%.
В настоящее время для диагностики вирусных растений используют иммуноферментную технику, моноклональные антитела, метод молекулярной гибридизации меченых фрагментов РНК- и ДНК-вироидов и вирусов с вирусами тестируемого объекта. Эти методы очень чувствительны, но трудоемки и дорогостоящи.
После оздоровления с помощью вышеперечисленных технологий нормальные растения-регенеранты размножают обычными методами клонального микроразмножения. Для некоторых растений, например цитрусовых, получить морфогенез из меристем малого размера не удается, поэтому требуется разработка оригинальных методов. Лимоны и апельсины оздоровляют и размножают, используя прививки меристем размером 0,14 — 0,18 мм на пробирочные подвои, полученные из семян. Достоинство такого подхода состоит и в том, что развивающиеся из меристем побеги не имеют ювенильных признаков, при этом цветение и плодоношение ускоряются.
6.8.4. Криосохранение
Сохранение разнообразия форм жизни — важнейшая проблема, с которой столкнулось современное человечество. Еще Г. Ф. Гаузе доказал, что устойчивость сообщества тем выше, чем больше число составляющих его видов. Следовательно, сохранение биоразнообразия — единственный механизм стабильности жизни на Земле.
Кроме того, для обеспечения питанием растущего населения нашей планеты необходимо выведение новых, более продуктивных сортов сельскохозяйственных растений, а для успешной селекции важен постоянный приток генов из новых источников. Традиционным источником генетического материала служат дикие виды растений. Однако в связи с расширением городов, сельскохозяйственных угодий, вырубкой лесов, ухудшением экологии эти виды постепенно вытесняются, а многие из них находятся на грани вымирания, поэтому их необходимо сохранить.
Существует несколько способов сохранения генофонда высших растений: заповедники, национальные парки, банки семян. В последнее время большое внимание уделяется созданию и развитию новых способов: пересадочных коллекций каллусных клеток, депонированию культур клеток и, наконец, криосохранению, т. е. хранению объектов при очень низкой температуре, обычно это температура жидкого азота (-196 °С). Криосохранение имеет существенные преимущества по сравнению с остальными методами. При сохранении в глубоко замороженном состоянии полностью прекращается обмен веществ, отсутствуют значительные физико- химические молекулярные изменения не только в клетке, но и в окружающей водной среде. Сохраняется генофонд, а следовательно, все свойства замороженного объекта. Единственный негативный фактор, которого не удается избежать, — это фоновая ионизирующая радиация. Однако, по мнению М.Ашвуд-Смита, потребуется примерно 32 000 лет для накопления 10% летальных хромосомных повреждений. Следовательно, криогенный метод дает возможность неограниченно долго хранить растительный материал без существенных изменений: сохраняются жизнеспособность клеток, их свойства, а также способность к морфогенезу и регенерации целых растений.
Сущность метода криосохранения сводится к замораживанию специально подготовленных растительных клеток при использовании криопротекторов — веществ, ослабляющих повреждения клеток при замораживании и оттаивании. В настоящее время известны * два метода криосохранения: программное (медленное) и сверхбыстрое замораживание. Программное замораживание изучалось уже : давно, поэтому оно довольно широко применяется для сохранения животных и растительных клеток. Разработка сверхбыстрого замо-^ раживания началась сравнительно недавно, однако считается, что | именно этот метод со временем станет наиболее перспективным. |
Трудности криосохранения растений связаны со спецификой 1 растительных клеток. Клетки растений имеют большие размеры! (в культуре тканей они изменяются от 15 до 1000 мкм), прочную! целлюлозную стенку и вакуоли. Причем именно степень вакуоли-! зации играет основную роль в устойчивости клеток к действию! низких температур. В зрелой клетке центральная вакуоль занимает!
до 90 % общего объема клетки, т. е. клетка представляет собой как бы резервуар с водой, которая необходима для ее нормальной жизнедеятельности. Поэтому основные факторы, способные привести клетку к гибели при замораживании, — это образование льда и дегидратация. Обычно кристаллы льда сначала образуются во внешнем растворе вокруг клеток. Максимальная скорость их роста в зависимости от состава раствора находится в пределах температур от -20 до -60 "С. При температуре -140 °С рост кристаллов льда совершенно прекращается. Следовательно, и при замораживании, и при оттаивании клеткам очень важно с оптимальной скоростью «проскочить» температуру образования льда. Кристаллы внеклеточного льда могут механически разрушать клетки. Кроме того, они играют водоотнимающую роль, что приводит к значительной дегидратации клетки и возможной ее гибели от осмотического стресса. При очень быстром замораживании лед может образовываться и внутри клеток, что ведет к разрушению в ней многочисленных мембран.
Избежать кристаллизации льда помогла бы витрификация воды, т. е. затвердение ее в аморфном состоянии. Получить витрифика- цию чистой воды практически невозможно. Но в коллоидных растворах скорость образования центров кристаллизации и роста кристаллов льда снижается и повышается температура, при которой их рост прекращается. Все это облегчает витрификацию. Добавление криопротекторов также затрудняет кристаллизацию льда и способствует витрификации.
Дата добавления: 2016-02-09; просмотров: 1091;
