БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ 12 страница
После выдерживания эксплантов в дезинфицирующем растворе их несколько раз промывают в дистиллированной воде и скальпелем удаляют наружный слой клеток на срезах эксплантов, так как он может быть поврежден при стерилизации.
Микроорганизмы могут находиться и внутри растительной ткани. Наиболее часто внутреннее инфицирование встречается у тропических и субтропических растений. Поэтому кроме поверхностной стерилизации иногда приходится применять антибиотики, которые и убивают микробную флору внутри ткани. Следует, однако, заметить, что подобная обработка не всегда приводит к стерилизации внутренних тканей, так как трудно выбрать направленно действующий антибиотик.
Питательные среды. Изолированные клетки и ткани культивируют на многокомпонентных питательных средах. Они могут существенно различаться по своему составу, однако, в состав всех сред обязательно входят необходимые растениям макро- и микроэлементы, углеводы, витамины, фитогормоны и их синтетические аналоги. Углеводы (обычно это сахароза или глюкоза) входят в состав любой питательной смеси в концентрации 2 — 3%. Они необходимы в качестве питательного компонента, так как большинство каллусных тканей лишено хлорофилла и не способно к автотрофному питанию. Поэтому их выращивают в условиях рассеянного освещения или в темноте. Исключение составляет кал- лусная ткань мандрагоры, амаранта и некоторых других растений.
Обязательными компонентами питательных сред должны быть ^ ауксины, вызывающие дедифференцировку клеток экспланта, и ци- токинины, индуцирующие клеточные деления. При изменении соотношения между этими фитогормонами или при добавлении других фитогормонов могут быть вызваны разные типы морфогенеза.
Высокое содержание нитратов, ионов аммония, калия, фосфата способствует быстрому росту клеток. Истощение среды значительно снижает рост и процессы вторичного метаболизма. Однако изначально низкое содержание фосфатов в питательной среде способно стимулировать синтез вторичных метаболитов. Установлено, что культивирование каллусов солодки голой на среде с половинной концентрацией азота и фосфора в темноте увеличивает содержание фенольных соединений в 1,6 раза по сравнению с каллусами, растущими на полной среде. В среду могут быть добавлены эндоспермы незрелых зародышей (кокосовый орех, конский каштан и др.), пасока некоторых деревьев, различные экстракты (солодовый, дрожжевой, томатный сок). Введение их в сре-. ду дает интересные результаты, но такие эксперименты трудно воспроизводимы, так как действующий компонент, как правило, точно неизвестен. Например, добавление в питательную среду отдельных фракций кокосового молока не давало никаких результатов, в то время как нефракционированный эндосперм вызывал деление клеток.
При приготовлении твердых питательных сред для поверхностного выращивания каллусных тканей используют очищенный агар-агар — полисахарид, получаемый из морских водорослей. В качестве примеров в табл. 6.2 приведены составы наиболее распространенных питательных сред.
Среда Мурасиге и Скуга — самая универсальная. Она пригодна для образования каллусов, поддержания неорганизованного кал-, лусного роста, индукции морфогенеза у большинства двудольных растений. Так, изменение соотношения ауксина и кинетина при- водит к образованию либо корней (преобладание ауксина), либо; стеблевых культур (преобладание кинетина).
Среда Гамборга и Эвелега хорошо подходит для культивирования клеток и тканей бобовых растений и злаков, среда Уайта обес-* печивает укоренение побегов и нормальный рост стебля после регенерации, а среда Нича и Нич пригодна для индукции андроц генеза в культуре пыльников.
Физические факторы. На рост и развитие растительных тканей; in vitro большое влияние оказывают физические факторы — свет,; температура, аэрация, влажность. |
Свет. Большинство каллусных тканей могут расти в условия^ слабого освещения или в темноте, так как они не способны фото*; синтезировать. Вместе с тем свет может выступать как фактору обеспечивающий морфогенез и активирующий процессы вторично!
| Таблица 6.2 Состав питательных сред, применяемых при культивировании клеток и тканей (по Р. Г. Бутенко, 1999)
|
го синтеза. В качестве источника света используют люминесцентные лампы. Для большинства травянистых растений оптимум освещенности составляет примерно 1000 люкс. Слишком низкая (300 люкс) или высокая (3000—10 000 люкс) освещенность подавляет рост. Освещение может влиять на метаболизм каллусных клеток. Так, в культурах чайного растения под действием света увеличивался биосинтез полифенолов. Напротив, в культуре клеток Scopolia parvi- flora свет подавлял образование алкалоидов. Кроме интенсивности освещенности на культуру ткани и ее физиологические особенности влияет качество света. Так, более 20 флавонов и флавоноловьп гликозидов образуется в культурах клеток петрушки после освещения ее непрерывным люминесцентным светом «холодный белый» Вместе с тем синтез флавоновых гликозидов активируется при последовательном облучении ультрафиолетовым светом, а затем светом, лежащим в области «красный—длинноволновый красный*
Температура. Для большинства каллусных культур оптимальна температура 26 °С. В то же время каллусы и культуры клеток диос кореи дельтовидной хорошо растут даже при температуре 32 °С. Б отличие от роста культур клеток и тканей индукция их морфогенеза требует более низких температур (18 — 20 °С). Влияние температуры на метаболизм клеток in vitro изучено слабо. Есть данные, что в каллусных культурах максимальное образование алкалоидов наблюдалось при температуре 25 °С, а при повышении температуры резко снижалось. В суспензионных культурах клеток Ipomoea содержание жирных кислот значительно увеличивалось, если их выращивали при субоптимальных температурах роста (15 °С) Поэтому при выращивании культуры in vitro необходимо тщательно изучать влияние всех абиотических факторов, в том числе температурного, на рост и метаболизм клеток.
Аэрация. Для выращивания суспензионных культур большое значение имеет аэрация. Особенно важно снабжение воздухом культивируемых клеток в больших объемах ферментеров.
При сравнении разных типов ферментеров было показано, что синтез вторичных метаболитов в суспензионной культуре был наибольшим при подаче воздуха снизу. При выращивании клеток в малых объемах (в колбах) нормальная аэрация достигается при постоянном перемешивании суспензии.
Влажность. Оптимальная влажность в помещении, где расту!, культуры, должна составлять 60 — 70%.
Таким образом, культивирование клеток и тканей зависит от многих факторов внешней среды, и действие их не всегда хорошо изве? стно. Поэтому при введении в культуру нового вида растений необ-т ходимо прежде всего тщательно изучить влияние физических фак торов на рост и физиологические характеристики этой культуры.
6.3. ДВДИФФЕРЕНЦИРОВКА КАК ОСНОВА I КАЛЛУСОГЕНЕЗА |
Культура изолированных тканей обычно представлена каллус ными и гораздо реже опухолевыми тканями. Каллусная ткань об разуется в результате повреждения на целых растениях, а также J стерильной культуре на эксплантах — фрагментах ткани или орга на, используемых для получения первичного каллуса. Возникновение каллуса связано с неорганизованным делением (пролиферацией) дедифференцированных клеток. Дедифференцировка — основа создания каллусной ткани. В процессе дифференцировки клетки теряют способность делиться. Дедифференцировка — это возвращение клеток в меристематическое состояние, при котором они сохраняют способность к делению. У интактных растений дедифференцировка и индукция каллусогенеза возникают вследствие образования раневых гормонов (травматиновая кислота) при механическом повреждении. Обязательное условие дедифферен- цировки тканей экспланта и превращения их в каллусные клетки, помимо повреждения, — присутствие ауксинов и цитокининов. Среди ауксинов чаще всего используют 2,4-D (2,4-дихлорфенок- сиуксусную кислоту), ИУК (индолил-3-уксусную кислоту), НУК (а-нафтилуксусную кислоту), причем наибольшую активность проявляет 2,4-D. Из цитокининов в искусственные питательные среды обычно вносят кинетин, 6-БАП (6-бензиламинопурин), зеатин. Наиболее активны 6-БАП и зеатин. Функции этих двух групп гормонов в каллусогенезе разные, но они тесно связаны между собой. Ауксины вызывают процессы дедифференцировки клетки, подготавливают ее к делению. Затем цитокинины инициируют деление клеток. Последние исследования свидетельствуют, что ауксины индуцируют синтез главной протеинкиназы клеточного деления P34cdc2, а цитокинины — циклинов. Таким образом, действие этих гормонов проявляется только при последовательном или одновременном внесении их в среду. Кроме того, оно будет зависеть от физиологического состояния клеток экспланта, от их компетентности к действию тех или иных внешних факторов. Результаты исследований показали, что полисахариды и какие-то неизвестные индукторы тоже могут вызывать деление клеток, приводящее к образованию каллуса.
Во время процесса дедифференциации, который у всех клеток сходен, клетки должны утратить характерные черты исходной ткани. В первую очередь они теряют запасные вещества — крахмал, белки, липиды. В них разрушаются специализированные клеточные органеллы, в частности хлоропласты, но возрастает число ами- лопластов. Кроме того, разрушается аппарат Гольджи, перестраиваются эндоплазматический ретикулюм и элементы цитоскелета.
Через несколько часов после перенесения экспланта в условия in vitro начинается новый синтез белка. Он связан, вероятно, с механическим повреждением и действием гормонов, сохранившихся в экспланте с момента его изоляции из растения. Когда данные гормоны израсходуются, синтез белка прекращается. Если в это время клетки будут культивироваться на питательной среде, содержащей ауксины и цитокинины, то начнется каллусогенез, т.е. в результате дедифференцировки и деления клеток будет образовываться первичный каллус. Таким образом, специализированная клетка растительной ткани становится каллусной в результате дедифференцировки, т.е. восстановления у нее способности к делению.
6.4. ТИПЫ КУЛЬТУР КЛЕТОК И ТКАНЕЙ
В зависимости от способа, условий культивирования и происхождения можно выделить несколько типов культур клеток и тканей. Если культивирование происходит поверхностно на агаризо- ванной питательной среде, то образуется каллусная ткань. Она не имеет четко выраженной структуры, но может различаться по плотности. Происхождение и условия выращивания определят, будет ли каллусная ткань рыхлой, средней плотности или плотной. Рыхлая каллусная ткань имеет сильно оводненные клетки, легко распадается на небольшие группы клеток и кластеры и поэтому может быть использована для получения суспензионной культуры. Ткань средней плотности характеризуется хорошо выраженными меристематическими очагами. В ней легко инициируются процессы органогенеза. Наконец, у плотных каллусных тканей различают зоны редуцированного камбия и трахеидоподобных элементов:
Культуры
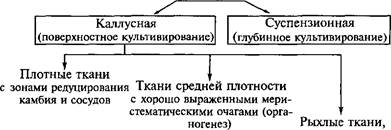 сильно обводненные, легко распадающиеся на отдельные клетки (получение суспензии)
сильно обводненные, легко распадающиеся на отдельные клетки (получение суспензии)
|
Существует также суспензионная культура клеток, которую выращивают в жидкой питательной среде, так называемое глубинное культивирование. Клеточные суспензии образуются как из каллусных тканей, так и непосредственно из экспланта. Для получения суспензионных культур предпочтительнее брать каллусы рыхлого типа. Если для этой цели необходимо использовать плотный каллус, то его можно разрыхлить, исключив из питательной среды соли Са2+. С этой же целью можно культивировать ткань на среде, содержащей ауксин 2,4-D или ферменты — пектиназу (0,2 мг/л) и целлюлазу (0,01 мг/л). Наилучший эффект достигается при добавлении ферментов. Суспензионные культуры клеток можно получить и непосредственно из экспланта по методу Ф. Стюарда. Для этого эксплант помещают в жидкую среду при постоянном автоматическом перемешивании. Дедифферениированные клетки отрываются от экспланта, образуя суспензию в питательной среде. Постоянное встряхивание — необходимое условие культивирования клеточных суспензий. Суспензионные клетки делятся в присутствии тех же двух групп гормонов (ауксинов и цитокининов), которые индуцируют деление клеток в каллусных тканях. Следовательно, можно сказать, что суспензионные культуры представлены разными агрегатами каллусных клеток.
Клеточные суспензии играют значительную роль в биотехнологии. Они могут быть использованы для получения изолированных протопластов, которые применяют для клеточной селекции, при введении чужеродных ДНК и других процессах. Клеточные суспензии культивируют в больших количествах для получения вторичных метаболитов, выявления новых веществ, для выращивания клеточной биомассы. Однако увеличение клеточной биомассы в результате деления клеток и синтез вторичных метаболитов разобщены во времени. Поэтому необходимо хорошо знать физиологию, свойства клеток в суспензионных культурах, чтобы получить максимальный выход продукта. Состояние клеточных суспензий характеризуется плотностью клеточной популяции. За 14 —16 дней (средняя длительность пассажа) плотность обычно повышается от 5-104 до 5-106 кл/мл. Качество суспензии определяется степенью агрегированное™. Агрегаты должны содержать не более 10 — 12 клеток.
Большой интерес представляет культура одиночных клеток. Ее применяют в клеточной селекции для отбора гибридных клеток и их клонирования, а также для генетических и физиологических исследований. Например, вопрос о причинах генетической неоднородности легче решать, используя клон-потомство одной клетки, а не гетерогенную ткань исходного экспланта.
Однако культивирование одной или нескольких клеток связано с определенными трудностями, состоящими в том, что одиночная клетка живет, но не делится в тех условиях, которые разработаны для нормального роста и размножения клеток каллус - ной ткани. Поэтому при культивировании одиночных клеток потребовалась выработка специальных методов. Все они основаны на использовании так называемого «кондиционирующего фактора» — метаболитов, выделяемых в среду делящимися клетками. Когда на питательную среду высаживается одна клетка или небольшое их количество, они не делятся, так как выделяемого кондиционирующего фактора не хватает для индукции деления. Следовательно, необходимо повысить концентрацию фактора в питательной среде. Этой цели служат следующие методы:
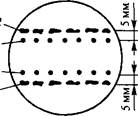
1. Метод ткани-«няньки» — кондиционирующий фактор выделяется находящимися рядом с одиночной клеткой кусочками тка- ни-«няньки» (рис. 6.1).
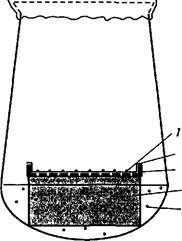
2. Метод «кормящего слоя» — кондиционирующий фактор выделяют активно делящиеся клетки суспензионной культуры того же вида растений, что и одиночная клетка (рис. 6.2).
3. Кондиционирование среды — осуществляется путем добавления в нее питательной среды, отфильтрованной от интенсивно делящихся клеток.
4. Метод культивирования одиночных клеток — осуществляется в микрокапле, т.е. в очень малом объеме (=20 мкл) богатой питательной среды (Ю.Ю.Глеба).
|
| Рис. 6.1. Выращивание отдельных клеток с помощью ткани-«няньки» (по Р. Г. Бу- тенко, 1999): 1 — одиночные клетки; 2 — каллусная куль- тура-«нянька» |
Точно сказать, что представляет собой кондиционирующий фактор, пока невозможно. Согласно исследованиям А.И.Павловой и Р. Г. Бутенко (1969), этот фактор водорастворим, термостабилен, не заменяется фитогормонами, включает низкомолекулярные вещества. Химическая природа кондиционирующего фактора доказывается с помощью довольно простого эксперимента. Если
|
| -2 Рис. 6.2. Использование культуры сус- _ j пензионных клеток в качестве «кор* |
| 5 ных клеток кукурузы (By Дык Куанг^ |
| 3. Б. Шамина, 1985): / — колонии клеток; 2 — фильтровал ная бумага; 3 — алюминиевая сетка; 4 пенополиуретан; 5 — суспензия клет |
|

|
мящего слоя» для выращивания изо-i лированных протопластов и одиноч-*
 Рис. 6.3. Доказательство химической природы фактора кондиционирования:
/ — одиночные клетки; 2 — ткань-«нянька»; 3 — делящиеся клетки; 4 — целлофан; 5— стеклянные пластинки
Рис. 6.3. Доказательство химической природы фактора кондиционирования:
/ — одиночные клетки; 2 — ткань-«нянька»; 3 — делящиеся клетки; 4 — целлофан; 5— стеклянные пластинки
|
разделить одиночные клетки и ткань-«няньку» стеклянной пластиной, то деления клеток не наступает. Если вместо пластин поместить целлофан, то хотя и с задержкой начинается деление одиночных клеток (рис. 6.3).
6.5. ОБЩАЯ ХАРАКТЕРИСТИКА КАЛЛУСНЫХ КЛЕТОК
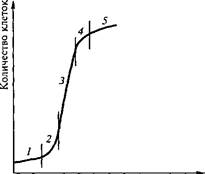
Каллусная клетка имеет свой цикл развития, аналогичный циклу всех других клеток: деление, растяжение, дифференциров- ку, старение и отмирание. Дифференцировку каллусных клеток принято называть вторичной. Однако ее не следует путать с вторичной дифференцировкой, на которой основан морфогенез. Рост каллусных тканей подчиняется общим закономерностям. Кривая роста каллусных тканей также имеет характер ^-образной кривой (ростовая кривая Сакса) и включает пять фаз, длительность которых неодинакова у разных видов растений (рис. 6.4).
Первая фаза — латентная, или лаг-фаза, заключается в подготовке клеток к делениям. Вторая — фаза экспоненциального роста (логарифмическая). В это время митотическая активность наибольшая,
рост идет с ускорением, масса каллуса увеличивается. Третья фаза — линейная, характеризуется постоянной скоростью роста каллусной массы. Четвертая — фаза замедленного роста, во время которой интенсивность деления клеток резко снижается. Во время пятой фазы — стационарной — масса каллуса не увеличивается, так как начавшееся отмирание клеток еще компенсируется за счет их деления. Далее следует отмирание каллуса.
Культивируемые каллусные клетки и ткани сохраняют многие физиологические особенности, свойственные клеткам растения, из которого они были получены. Сохраняются, например, такие свойства, как морозостойкость, устойчивость к абиотическим факторам (температура, засоление, фотопериодическая реакция), а главное, хотя и в разной степени, способность к синтезу вторичных метаболитов. Наряду с общими у каллусных клеток появляются свои, характерные только для них особенности. Например, длительно культивируемые in vitro клетки высших растений, как каллусные, так и суспензионные, образуют специфическую популяцию, относящуюся к типу неполовых, — популяцию соматических клеток. Наиболее характерные свойства этой популяции — физиологическая асин- хронность и генетическая гетерогенность.
Физиологическая асинхронностъ — наиболее важное свойство не-: половой популяции. Оно заключается в том, что в каждый дан-! ный момент времени клетки находятся в разных фазах роста: однц делятся, другие растут, а третьи уже стареют. Поэтому общее физиологическое состояние такой популяции принято оценивать по состоянию большинства клеток. )
Причины возникающей асинхронности весьма разнообразны!?
1. Особенности вида, сорта, генотипа индивидуального растер ния, а также особенности экспланта. |
2. Стрессы культивирования, например неоптимальная для дан^ ного вида клеток среда. |
3. Изменение баланса эндогенных гормонов и концентрации | среде экзогенных гормонов в течение выращивания. |
4. Генетическая гетерогенность клеток и клонов. |
5. Аномалия митотического цикла клеток in vitro. |
6. Физические факторы (температура, свет, аэрация). |
170 '!
 Время культивирования
Рис. 6.4. Ростовая кривая при периодическом выращивании каллусных тканей:
Фазы роста: 1 — латентная; 2 — логарифмическая; 3 — линейная; 4 — замедленного роста; 5 — стационарного роста
Время культивирования
Рис. 6.4. Ростовая кривая при периодическом выращивании каллусных тканей:
Фазы роста: 1 — латентная; 2 — логарифмическая; 3 — линейная; 4 — замедленного роста; 5 — стационарного роста
|
sj
Асинхронность — устойчивое свойство популяции каллусных клеток. Если с помощью специфических воздействий синхронизировать пролиферацию клеток популяции, то уже через 3—4 деления она вновь становится асинхронной.
Генетическая гетерогенность — свойство клеток соматической популяции (нестабильность генома и их генетическая гетерогенность). Генетически стабильными считаются только клетки меристематических тканей. В клетках остальных тканей при культивировании могут возникать полиплоидия, анеуплоидия, хромосомные аберрации, генные мутации. Однако генетическую гетерогенность нельзя рассматривать как недостаток, так как она является необходимым условием существования популяции клеток и служит основой для их адаптации.
В качестве причин появления генетической гетерогенности можно назвать следующие:
1. Генетическая гетерогенность исходного материала. В растениях клетки характеризуются различной плоидностью, диплоидны только активно делящиеся меристематические клетки.
2. Нарушение коррелятивных связей при выделении первичного экспланта из растения.
3. Действие компонентов среды. Экзогенные гормоны и стимуляторы могут оказывать мутагенное действие. Ауксины, особенно 2,4-D, входящие в состав питательных сред, — мутагены; цитоки- нины способствуют полиплоидизации клеток.
4. Длительное субкультивирование, при котором накапливаются генетически измененные каллусные клетки.
После 5 — 6 пересадок новый кариотип клеточной популяции, как правило, стабилизируется, если условия культивирования остаются постоянными. В противном случае изменение физических или трофических факторов приведет к новым генетическим изменениям.
Генетическая нестабильность каллусных клеток имеет большое значение для селекционной работы, так как позволяет отбирать штаммы клеток с измененным генотипом. Эти клетки могут обладать уникальными свойствами: повышенной устойчивостью к неблагоприятным факторам, повышенной продуктивностью и т.д. Однако генетическая гетерогенность популяций каллусных клеток в культуре не влияет на сохранение в их геноме основных качеств вида и растения-донора.
Гормоннезависимость. Хотя гормоны и вызывают мутации, каллусные ткани от большинства растений образуются только в присутствии в питательной среде и ауксинов, и цитокининов. Исключение составляют, например, незрелые зародыши пшеницы и семядоли подсолнечника. Первые образуют каллусную ткань на питательной среде с 2,4-D, но без цитокининов. Вторые, напротив, — на среде, содержащей цитокинины, но без ауксинов.
Вероятно, такая специфика связана с эндогенным содержанием фитогормонов и с компетентностью клеток. Однако при длительном культивировании практически у всех тканей может возникать специфическое свойство гормоннезависимости, т.е. автономности по отношению к ауксинам и цитокининам. Эти ткани могут расти на среде без гормонов, что делает их похожими на опухолевые клетки и резко отличает от нормальных каллусных тканей. Внешне же такие гормоннезависимые ткани ничем не отличаются от каллусных.
Клетки, которые в процессе культивирования приобрели свойство автономности от присутствия в среде гормонов, называются «привыкшими». Ткани, образованные такими «привыкшими» клетками, называют «химическими опухолями» в отличие от растительных или генетических опухолей. Генетические опухоли возникают на межвидовых гибридах растений. Растительные опухоли имеют бактериальное или вирусное происхождение. Чаще всего растительные опухоли возникают при попадании в растения агробакте- рий. Так, Agrobacterium tumefaciens вызывает образование корончатых галлов, A. rhizodenes — бородатого корня, A. rubi — стеблевого галла. Превращение растительных клеток в опухолевые связано с проникновением в них ДНК бактериальной клетки, так называемой Ti-плазмиды, которая значительно изменяет свойства клетки, в том числе экспрессирует гены, контролирующие синтез ауксинов и цитокининов. Гормоннезависимость «привыкших» клеток связана с изменением активности собственных генов, ответственных за синтез белков-ферментов, участвующих в синтезе гормонов. Таким образом, «привыкшим» тканям и растительным опухолям в равной степени свойственна гормоннезависимость, но у растительных опухолей она носит генетический характер. У «привыкших» клеток это свойство достигается главным образом за счет эпигеномных изменений. Существует еще одна особенность, позволяющая отличить «привыкшие» и опухолевые клетки от обычных каллусных. Обычно ни опухолевые, ни «привыкшие» ткани не способны к нормальной регенерации. Они могут образовывать уродливые органоподобные структуры, так называемые тератомы. В отдельных случаях у длительно культивируемых тканей удается отодвинуть порог «привыкания» благодаря изменению состава питательных сред и добиться регенерации нормального растения.
Дата добавления: 2016-02-09; просмотров: 1932;
