БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ 8 страница
1. Специфическое расщепление ДНК рестрикцирующими нук- леазами, что в значительной степени ускоряет выделение различи ных генов и манипуляции с ними.
2. Быстрое секвенирование всех нуклеотидов в очищенном фраг-, менте ДНК, позволяющее определить точные границы гена и ко? дируемую им аминокислотную последовательность полипептида;,
3. Гибридизация нуклеиновых кислот, позволяющая с большой точностью выявить специфические нуклеотидные последователь! ности на основе их способности связывать комплементарные ос; нования. I
4. Клонирование ДНК, суть которого сводится к введению ДНК| фрагмента в самореплицирующийся генетический аппарат (плазмИ ду или вирус), который используют для трансформации бактери' Бактериальная клетка после трансформации способна воспрои" водить этот фрагмент во многих миллионах идентичных копий.
5. Генетическая инженерия, позволяющая получать модифиЩ рованные версии генов и затем внедрять их в клетки или органи' мы.
Технология рекомбинантных ДНК оказала существенное вс действие на всю клеточную биологию, позволяя решать такие 31
'V
дачи, как определение строения и функций не только белков, но и индивидуальных доменов, а также расшифровывать механизмы регуляции экспрессии генов, получать многие белки, участвующие в регуляции обменных процессов, клеточной пролиферации и развитии организма.
Расщепление ДНК в специфических участках нуклеотидных последовательностей осуществляется особыми ферментами — рест- рикцирующими нуклеазами, способными разрушить чужеродную ДНК. Все ферменты условно можно разделить на следующие группы:
1) используемые для получения фрагментов ДНК;
2) синтезирующие фрагменты ДНК на матрице РНК;
3) соединяющие фрагменты ДНК;
4) позволяющие осуществить изменение структуры концов фрагментов ДНК;
5) применяемые для приготовления гибридизационных проб.
Каждый фермент, способный разрушить чужеродную ДНК,
опознает в ней специфическую последовательность из 4 —6 ну- клеотидов. Соответствующие последовательности в геноме бактерий замаскированы метилированием остатков с помощью метилаз.
Согласно номенклатуре, предложенной Х.Смитом и Д.Натансоном, название рестриктазы складывается из трех букв: первая обозначает родовое название, две последующие — первые буквы вида. Например, фермент из Е. coli обозначают как Есо или из Haemophilus influenzae — Hin и т.д. Типовая или штаммовая идентификация следует за родовидовой, например, EcoRI или Hindll и т.д. В настоящее время различные фирмы выпускают более 100 разнообразных ферментов, опознающих различные последовательности нуклеотидов. Для каждого конкретного фермента они различаются по длине, первичной структуре и способу разрыва молекулы ДНК. Подавляющее большинство ферментов разрывает только двуни- тевую ДНК с образованием серии Рис 5л участки узнавания Фрагментов, называемых рестрикци- дНК тремя реСтриктазами из онными (или рестриктами; с тупы- Haemophilus parainfluenzae МИ либо липкими концами (рис. 5.1). (Hpal); Escherichia coli (EcoRI)
| Hpal А-А-С-3' |
| 5'—G—Т-Т-- |
| 3'-C-A-A-|-T-T-G -5' Расщепление |
| EcoRI A—A—T—Т— С—3' |
| 5-G-j- |
| 3'—С—T—T—A—A--G— 5' Расщепление |
| Hindlll •A—G—С—Т— Т— 3' |
| 5'- А |
| 3'~Т—T—С—G—А+А—5' Расщепление |
Многие рестриктазы вносят разры- и Haemophilus influenzae вы в две цепи ДНК со смещением на (Hindlll)
несколько нуклеотидов и образованием на концах фрагменте! коротких одноцепочечных участков. Они способны образовывать комплементарные пары оснований с любым другим одноцепо- чечным участком, полученным с помощью того же фермента (липкие концы). Липкие концы позволяют легко соединить два любы;, фрагмента ДНК в одно целое. Полученный фрагмент ДНК (любого происхождения) можно встроить в очищенную ДНК плазми- ды или бактериального вируса.
Сравнение размеров фрагментов ДНК после обработки соответствующего участка генома набором рестриктаз позволяет построить рестрикционную карту, отражающую расположение определенной последовательности нуклеотидов в данном участке Сравнением таких карт можно оценить степень гомологии межд\ отдельными генами (участками) без определения их нуклеотид ной последовательности. Рестрикционные карты важны для клонирования ДНК, решения эволюционных и филогенетических задач.
Для успешного решения задач генетической инженерии оченж важно быстро секвенировать (определить последовательность нук| леотидов) любые очищенные фрагменты ДНК. В настоящее врем$ объем информации о последовательностях ДНК столь велик, чт<| для хранения и анализа данных о фрагментах, целых геномах ней» обходимы новые технологии и компьютерная техника. «
Исходный фрагмент ДНК, меченный 32Р по 5'-концу
| 5' |
| T-G-C-T |
P-T-G-C-A-C-T-T-G-A-A-C-G-C-A-T-G-C-T
Расщепление ДН К по остаткам (а)-,'
P-T-G-C-A-C-T-T-G-A-A-C-G-C
Р—Т—G—С—А—С—Т—Т—G—А + C-G-C-A-T-G-C-T
| Р-Т-G-С-А-С-Т-Т-G |
A-C-G-C-A-T-G-C-T
| P-T-G-C |
С-Т -T-G -А-А-С -G -С -А -Т -G -С -Т
| Радиоактивные фрагменты |
| Гель |
Немеченые фрагменты
Электрофореграмма
Рис. 5.2. Схема получения семейства меченных по 5'-концу фрагмен ДНК в результате расщепления по определенному нуклеотиду (А)
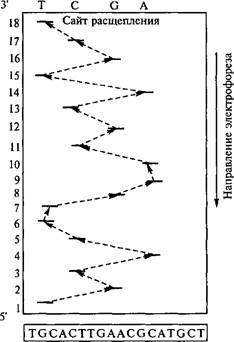
В биотехнологии рекомбинантных ДНК обычно используют два различных метода секвенирования ДНК: химический и ферментативный. Оба метода чрезвычайно надежны, быстры в исполнении й результативны. Результаты секвенирования позволяют также на основе генетического кода определить аминокислотную последовательность белка в соответствии с нуклеотидной последовательностью в соответствующем гене. На рис. 5.2 представлена схема химического метода секвенирования ДНК Исходный фрагмент ДНК, меченный 32Р по 5'-концу, подвергается специфическому расщеплению по определенному нуклеотиду (например, А), в результате чего образуются радиоактивные фрагменты разной длины, которые разделяются по размерам при гель-электрофорезе, а радиоактивные из них выявляются с помощью радиоавтографии.
Обычно химическая процедура расщепления ДНК выполняется одновременно для четырех одинаковых проб ДНК с использованием химических агентов, расщепляющих ДНК по отдельным нуклеотидам (Т, С, G и А). Полученные образцы подвергают электрофорезу на параллельных дорожках одного геля, и по его результатам можно определить нуклеотидную последовательность ДНК (рис. 5.3).
Энзиматический метод секвенирования основан на энзиматичес- ком введении нуклеотида, терминирующего полинуклеотидную цепь (рис. 5.4). В этом случае обычно используют дидезоксирибо- нуклеозидтрифосфаты, в которых дезоксирибоза-З'-ОН, представленная в нормальных нуклеотидах, отсутствует. Такой модифицированный нуклеотид, внедряясь в цепь ДНК с помощью ДНК- полимеразы, блокирует присоединение следующего нуклеотида. Синтез in vitro молекулы ДНК в присутствии затравки (прайме- ра) и небольшого количества одного из таких модифицированных нуклеотидов приводит к образованию фрагментов ДНК в виде «лесенки». Если для получения таких фрагментов применять меченую ДНК (обычно проводят четыре реакции синтеза с использованием различных нуклеотидов, терминирующих цепь), а электро- форетический анализ проводить на четырех дорожках геля, то можно определить последовательность нуклеотидов. В настоящее время используют модифицированный метод, сводящийся к флуоресцентному анализу наборов фрагментов ДНК в процессе движения по одной дорожке геля.
Важнейший метод получения рекомбинантных ДНК основан на способности нуклеиновых кислот быстро восстанавливать свою структуру после нагревания до 100 "С в сильно щелочной среде (рН 13). При нагревании до 100 °С комплементарные пары оснований разрушаются и ДНК диссоциирует на две раздельные цепи. Этот процесс назван денатурацией ДНК («плавлением»). Выдерживание комплементарных цепей при температуре 65 °С приводит
 Последовательность нуклеотидов во фрагменте ДНК
Рис. 5.3. Схема электрофореграммы, полученной с помощью химического метода секвенирования ДНК (первая снизу строка соответствует нук- леотиду на 5'-конце и является нуклеотидом Т на уровне первой дорожки. Для определения полной последовательности (отмечено пунктиром) проводят анализ послойно всех дорожек
Последовательность нуклеотидов во фрагменте ДНК
Рис. 5.3. Схема электрофореграммы, полученной с помощью химического метода секвенирования ДНК (первая снизу строка соответствует нук- леотиду на 5'-конце и является нуклеотидом Т на уровне первой дорожки. Для определения полной последовательности (отмечено пунктиром) проводят анализ послойно всех дорожек
|
к их спариванию и восстановлению структуры двойной спирали (гибридизация, ренатурация, или «отжиг»). Это свойство ДНК широко используют в химической систематике, а также для решения эволюционных и филогенетических проблем.
Скорость восстановления (ренатурации) двойной спирали зависит от вероятности столкновения двух комплементарных нук- леотидных последовательностей и их концентрации в растворе. Скорость реакции гибридизации можно использовать для определения концентрации любых последовательностей РНК или ДНК в смеси, содержащей и другие фрагменты нуклеиновых кислот. Для этого необходимо иметь чистый одноцепочечный фрагмент ДНК, комплементарный к тому фрагменту, который надлежит выявить. Обычно фрагмент ДНК, полученный клонированием либо химическим путем, метят по 32Р в целях прослеживания включения фрагмента в состав дуплексов при гибридизации. Одноцепочеч-
А
Флуоресцентно-меченная затравка для ДНК-полимеразы
Смесь дНТФ с добавлением небольшого количества дидНТФ
| ДНК-пол имераза ----------- ^ 5' |
5'У///////Л GCTACCTGCATGGA
з'ШЯгггШгЕс CGATGGACGTACCTCTGAAGCG^
Одноцепочечная ДНК, нуклеотидную последовательность которой надо определить
Включение дидНТФ блокирует дальнейший рост молекулы ДНК
gctacctgcatgga Y/МШЛ GCTA
УМ////М ГгГТАГГТГ.ГА
Смесь флуоресцирующих молекул комплементарной ДНК различной длины, оканчивающихся на А
СИЗ
| У////////Л |
| У///Ш/Л |
 Рис. 5.4. Схема энзиматического метода секвенирования нуклеиновых кислот, основанного на энзиматическом введении нуклеотида, терминирующего цепь:
Рис. 5.4. Схема энзиматического метода секвенирования нуклеиновых кислот, основанного на энзиматическом введении нуклеотида, терминирующего цепь:
|
| 5' GCTACCTGCATGGAGACTTCGC 3' Малые Самые ^Концевой молекулы большие дидНТФ молекулы |
| Л — синтез in vitro в присутствии затравки с образованием «лесенки» фрагментов; Б — инкубация четырех различно окрашенных флуоресцирующих затравок в смеси нуклеотидов с добавлением различных дидНТФ, прекращающих рост цепи (A,T,C,G) ную молекулу ДНК, используемую в данном методе в качестве меченого индикатора, называют ДНК-зондом. Размеры его варьируют от нескольких десятков до нескольких сотен и тысяч нуклеотидов. Реакция гибридизации с использованием ДНК-зондов позволяет идентифицировать нуклеотидные последовательности |
щщш
?
Смесь молекул Смесь молекул, Смесь молекул, Смесь молекул,
различной длины, оканчива- оканчива- оканчива-
оканчивающихся на А ющихся на Т ющихся на С ющихся на G
в очень низкой концентрации и тем самым определять, какое количество копий последовательности ДНК, комплементарной ДНК- зонду, присутствует в геноме клетки.
ДНК-зонды применяют для поиска родственных генов; в реакциях гибридизации с РНК — для выявления экспрессии данного гена в различных клетках. Для выявления молекул нуклеиновых кислот, комплементарных всему зонду (или его участку), ДНК- зонды часто сочетают с методом гель-электрофореза, что позволяет получать информацию о размерах гибридизируемых молекул ДНК. Эффективное использование современных приборов, способных автоматически синтезировать любые нуклеотидные последовательности за короткий промежуток времени, дало возможность перестраивать гены, что представляет собой один из важных аспектов генной инженерии. Обмен генами, а также введение в клетку гена другого вида организма осуществляют посредством генетической рекомбинации in vitro. Этот подход был разработан на бактериях, в частности на Е. coli. Он основан на важном свойстве ДНК — способности к перестройкам, изменяющим комбинацию генов в геноме и их экспрессию. Такая уникальная способность ДНК позволяет приспосабливаться данному виду к изменяющейся среде. Генетическую рекомбинацию подразделяют на два больших класса: общую рекомбинацию и сайт-специфическую рекомбинацию. В процессе общей рекомбинации генетический обмен в ДНК происходит между гомологичными нуклеотидными последовательностями, например между двумя копиями одной и той же хромосомы в процессе мейоза (кроссинговера), или при скрещивании и перегруппировке генов у бактерий.
В процессе сайт-специфической рекомбинации в обмен вступают короткие специфические нуклеотидные последовательности одной и той же или обеих спиралей ДНК, распознаваемые особым сайт-специфическим ферментом, что приводит к трансформации распределения нуклеотидных последовательностей в геноме. Любые комплементарные взаимодействия между двумя гомологичными спиралями ДНК возможны лишь тогда, когда в одной из двух цепей происходит разрыв. К числу факторов, вызывающих такие одноцепочечные разрывы, относят: химические агенты, некоторые виды излучения, специфические белки. Например, у Е. coli обнаружен белок rec BCD, который вызывает в молекулах ДНК одноцепочечные разрывы. Белок rec BCD представляет собой ДНК- зависимую АТРазу, которая действует как ДНК-хеликаза, перемещающаяся по спирали ДНК и вызывающая ее расплетение. Под влиянием этого белка, обладающего нуклеазной и хеликазной активностью, на двойной спирали ДНК возникает разрыв с образованием одноцепочечного участка «ус» (whisker) (рис. 5.5).
Белок rec BCD присоединяется к двойной спирали ДНК с одного конца (5') и со скоростью около 300 нуклеотидов в секунду
движется вдоль спирали ДНК за счет гидролиза АТР. Одновременно с белком движется и возникшая петля ДНК. Когда петля на спирали достигает участка, называемого сайтом узнавания (recognition site), одна из цепей разрывается с освобождением небольшого одноцепочечного участка «ус». Возникший «ус» инициирует дальнейшую генетическую рекомбинацию.
Белок rec BCD
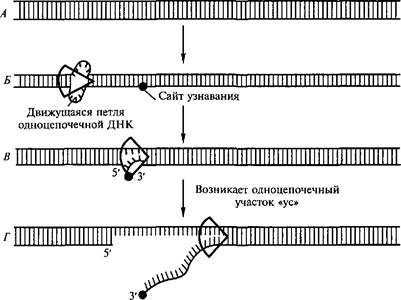 Рис. 5.5. Схема процесса общей рекомбинации с участием белка rec BCD
у E.coli:
А — двойная спираль ДНК; Б — присоединение к двойной спирали белка rec BCD с последующим его перемещением; В — возникновение разрыва в сайте узнавания; Г — образование одноцепочечного участка «ус»
Рис. 5.5. Схема процесса общей рекомбинации с участием белка rec BCD
у E.coli:
А — двойная спираль ДНК; Б — присоединение к двойной спирали белка rec BCD с последующим его перемещением; В — возникновение разрыва в сайте узнавания; Г — образование одноцепочечного участка «ус»
|
| + |
В процессе общей генетической рекомбинации центральная роль отводится комплементарным взаимодействиям нуклеотид- ных последовательностей. Кроме того, этот процесс требует участия особого белка гесА с Mr, равной 38 кДа. Белок гесА прочно связывается в виде крупных кластеров с одиночными цепями ДНК, одновременно удерживая и двойную спираль. За счет двух сайтов данный белок имеет еще один участок — для связывания и гидролиза АТР, т.е. он представляет собой ДНК-зависимую АТРазу. Благодаря особенностям белка гесА осуществляются од-
| L |
| Обмен между цепями |
| Высвобождение одной из цепей |
| Разрыв |
Рис. 5.6. Схема начального одноцепочечного обмена между двумя гомологичными двойными спиралями ДНК в процессе общей рекомбинации
ноцепочечный обмен между двумя двойными спиралями (рис. 5. с удалением некоторого количества нуклеотидов и локальный ре синтез ДНК.
Разрыв в одной из цепей ДНК высвобождает эту цепь, и он внедряется во вторую спираль, образуя короткий спаренный учас
ток. После начального обмена roMi логичные нуклеотидные последовг тельности двух взаимодействующв спиралей устанавливаются в строго соответствии одна с другой, в связс с чем происходит расширение обл? сти спаривания и быстрый обме между спиралями. Для этого процеа, разные организмы используют нес динаковые механизмы, большинств из которых включает в качестве прс межуточного этапа обмен с перекр. щиванием цепей между двумя сш ралями ДНК (рис. 5.7).
Структура, образующаяся при оР мене с перекрещиванием цепей, сС держит две перекрещенные и две н перекрещенные цепи. Она способ? : существовать в различных изомернР
| Две гомологичные спирали ДНК |
| Разрыв цепи и обмен |
| Разрыв цепи и обмен |
| ♦ |
| Сшивание разорванных цепей |

| Равноценные структуры |
| Рис. 5.7. Схема образования структуры с перекрещиванием цепей между двумя спиралями ДНК |
формах. Изомеризация меняет пол| жение двух пар цепей: две ранее п! рекрещивающиеся цепи становяТ( неперекрещивающимися и наобор<1 Для того чтобы восстановили^ две отдельные спирали ДНК и flj самым прекратился процесс спар вания, в каждой из двух перекрещён ных цепей должен произойти разр! (рис. 5.8).
--- AT Г Ц AATT ЦАГТЦ
ТАЦГ ТТААГТЦАГ
Сшивание | ДНК-лигаза
АТГЦ-ААТТ-ЦАГТЦ ТАЦГ-ТТАА-ГТЦАГ
-АТГЦААТТ ЦТГАГАТЦЦА ТАЦГ
ТАЦГ ТТААГАЦТЦТ АГГТАТГЦ
Фрагмент 1 Линкер Фрагмент 2
----- AT ГЦ Г Г Г Ц Ц Ц ГТ А Ц-------------
--- ТАЦГЦЦЦ Г Г ГЦА Т Г-----
Мет Тир Гли Гли Фен Лей Stop , I 11 I I м и м 11 I ,.
.ААТТ^ЦАТГТАТГГТГГЦТТТЦТГТАА
ГТАЦАТАЦЦАЦЦГАААГАЦАТТЦТАГ'^
■ EcoRI \BamHI
«Липкий» \
конец «Липкий»
конец
Один из важных этапов конструирования молекулы ДНК лигирование (или сшивание) генов с помощью фермента ДНК лигазы. Сшивание фрагментов ДНК, содержащих нужные гень осуществляют двумя основными методами: а) по «липким» кой* цам; б) с помощью искусственно достроенных «липких» концов Сшивание генов (фрагментов) ДНК по «липким» концам, т.1 взаимнокомплементарным участкам, длиной из 4—6 пар нукле< тидов, достаточно легко осуществляется ферментом ДНК-лиг^ зой с образованием ковалентной фосфодиэфирной связи меж!| соседними нуклеотидами:
--АТГЦААТТ ЦАГТЦ----------- V
ТАЦГ ТТААГТЦАГ----------- *
Сшивание | ДНК-лигаза AT Г Ц ААТТ-ЦАГТЦ
ТАЦГ-ТТАА-ГТЦАГ •
if Ее
Чаще других в генетической инженерии в качестве векторов используют плазмиды. Плазмидами называют бактериальные репликоны (внехромосомные элементы наследственности), стабильно наследуемые. Они представляют собой двуцепочечные кольцевые молекулы ДНК с вариабельными молекулярными массами. По размеру они соответствуют 1 — 3 % генома бактериальной клетки. Так, молекулярная масса одной из самых мелких плазмид, найденных у Е. coli, составляет 1,5 МДа, а клетки псевдомонад содержат плазмиды с Mr около 300 МДа, что составляет 15 % от Mr хромосом этих бактерий. Плазмиды разделяют на конъюгативные, способные сами перенестись в реципиентные клетки с помощью конъюгации, и не конъюгативные, не обладающие этим свойством. Они детерминируют разные свойства: резистентность к антибиотикам (R-плазмиды); биодеградацию (D-плазмиды) и др. Например, плазмиды стафилококков несут гены устойчивости к пенициллину, соединениям ртути и др. Гены устойчивости к тяжелым металлам обнаружены также в составе R-плазмид Е. coli. Плазмиды могут управлять синтезом инсектицида в клетках Bacillus thuringiensis. F- плазмида Е. coli или FP-плазмиды псевдомонад являются половыми факторами. Плазмида pS 101 с Mr 5,8 МДа несет ген устойчивости к тетрациклину (селективный маркер). У различных микроорганизмов — Е. coli, Salmonella, Bacillus, Saccharomyces обнаружены Col-плазмиды, обеспечивающие синтез разных ко- лицинов — высокоспецифических антибиотиков, подавляющих жизнедеятельность других штаммов микроорганизмов того же вида или родственных видов. Количество плазмид в клетке может колебаться от одной до более ста. В целом чем крупнее плазмида, тем меньше количество ее копий в клетке.
Первый плазмидный вектор был получен С.Коэном (1973). Его источником была плазмида Е. coli R6_5 с Mr 65 кДа. Плазмида стала родоначальником серии векторов и других структур. Особое место в генетическом манипулировании занимает плазмида, относящаяся к группе колициногенных плазмид Е. coli. Col El реплицируется независимо от хромосомы и присутствует в количестве примерно 24 копий на клетку. Ее широко используют благодаря селективному маркеру в качестве вектора для клонирования фрагментов про- и эукариотической ДНК в Е. coli.
Плазмида ColEl (Mr 4,2 МДа) применяется для клонирования EcoRl-фрагментов. При этом интеграция чужеродного фрагмента в участок узнавания EcoRI ведет к фенотипическому изменению клетки, прекращению синтеза колицина с сохранением иммунности к нему. Этот признак используют при отборе рекомбинантных трансформантов.
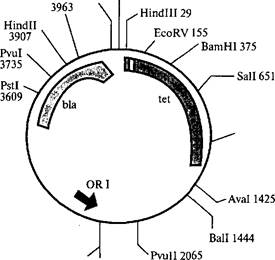
Плазмида pBR313 содержит уникальные участки расщеплений нескольких рестриктаз: EcoRI, Hindlll, BamHI, Sail, Xmal и Hpal. Конструируя рекомбинантную ДНК, в эти участки можно встра
ивать фрагменты чужеродной ДНК, полученные с помощью соответствующих рестриктаз. На рис. 5.10 изображена схема расположения генов в плазмиде pBR322. Плазмида pBR322 содержит два гена, программирующих устойчивость к двум различным антибиотикам — тетрациклину (ген tet) и ампициллину (ген Ыа). В гене tet находятся уникальные участки расщепления рестриктаза- ми Hindlll, BamHI и Sail, а в гене Ыа — участок расщепления Pstl. Если разрезать плазмиду любой из рестриктаз, участок расщепления которой находится в гене tet, и соединить ее методом «липких» концов с чужеродным фрагментом ДНК, то в полученной рекомбинантной молекуле останется нетронутым только ген Ыа, а ген tet утрачивает свою активность, так как его целостность нарушается вставкой. Напротив, при разрезании плазмиды рестрик- тазой Pstl и внедрении в этот участок фрагмента ДНК инактиви- руется ген Ыа, тогда как ген tet продолжает кодировать белок, обеспечивающий устойчивость Е. coli к тетрациклину. Плазмид- ные векторы в настоящее время чрезвычайно разнообразны за счет следующих свойств:
уменьшения размеров плазмиды вследствие изъятия участков, не обязательных для репликации (чем больше плазмида содержит уникальных участков узнавания для рестриктаз, тем она универсальнее);
EcoRI XmnI 4361 Clal 23
 ACGI 2246
2246 Snal 2246 Рис. 5.10. Схема строения плазмиды pBR322
ACGI 2246
2246 Snal 2246 Рис. 5.10. Схема строения плазмиды pBR322
|
| Xmalll 939 |
гибридизации векторов одного рода с другими векторами или природными плазмидами (например, получены гибридные векто
ры комбинацией плазмиды и фага X (при этом вновь сконструированная рекомбинантная ДНК должна сохранить репликационные свойства исходной плазмиды);
использования новых плазмид;
применения транспозонов;
создания векторов с генетическими маркерами, позволяющими вести отбор рекомбинантных клонов.
Эукариотические вирусы до сих пор нашли более скромное применение в качестве векторов. Практически используются только онкогенный вирус SV 40 и его производные. Все эти векторы — дефектные вирусы, не способные давать полноценные вирусные частицы в клетке хозяина. Анализируемую ДНК можно вводить и в другие репликоны, способные размножаться в клетках, например бактериофаги. Чаще всего из известных фагов в качестве векторов применяют сконструированные производные фага X и фагов М13 и fd. В векторах на основе бактериофага X используется его особенность, состоящая в том, что большая часть его ДНК не участвует в размножении фага в клетке. Это позволяет вводить чужеродную ДНК в ДНК фага X в качестве вектора.
Фаг М13 — это одноцепочечная циклическая ДНК длиной около 6500 нуклеотидов. После инфицирования бактериальной клетки одноцепочечная ДНК фага превращается в двуцепочечную реп- ликативную форму (RF), которая подобна плазмиде. Фаговая ДНК содержит, кроме того, короткий участок из 500 нуклеотидов, названный как МП (межгенная последовательность), не существенный для ее жизнедеятельности. Именно в этот участок МП репли- кативной формы ДНК после расщепления ее с помощью лигазы вставляют чужеродную ДНК. Введение рекомбинантной двуцепо- чечной молекулы в клетку Е. coli приводит к ее репликации, синтезу (+) цепи, упаковке последней в белковый чехол и выделению фага в среду. Инфицированная нитевидным фагом клетка продолжает делиться, выделяя в окружающую среду большое количество фага. Этот фаг содержит в вирионе одноцепочечную циклическую ДНК, в которую встроена одна из цепей чужеродной ДНК.
| I |
Векторные плазмиды и векторные вирусы со встроенными чу-4 жеродными генами часто называют гибридными (или химернымиi); плазмидами (или фагами). После конструирования рекомбинант-f ных ДНК их с помощью трансформации вводят в реципиентный организм: бактериальную, грибную, растительную или животнук? клетку. Трансформация предусматривает предварительную o6paf ботку клеток соединениями, обусловливающими проникновени| ДНК внутрь клеток с последующим их помещением в среду, I которой способны существовать только клетки, получившие вещ торную молекулу, например в среду с определенным антибий тиком. 1
120
Процесс инфицирования клеток с помощью чужеродных ДНК, приводящий к образованию зрелого фагового потомства, назван трансфекцией.
Практически общий способ трансформации и трансфекции основан на том, что при обработке клеток бактерий СаС12 их мембрана становится проницаемой для ДНК. Однако эффективность проникновения экзогенной ДНК в клетку довольно низка. Поэтому среди бактерий, подвергшихся трансформации, только небольшая часть оказывается трансформированной. Отделение ее от общей массы осуществляется в процессе клонирования. Для клонирования бактериальную суспензию определенной концентрации выливают на твердую питательную среду, например на агар с питательными добавками в чашке Петри из расчета 5—10 бактерий на 1 см2 поверхности. Бактериальная клетка на поверхности агара начинает делиться с образованием в итоге маленькой колонии, похожей на шляпку гриба. Эта колония называется клоном, причем из каждой клетки образуется свой клон, все клетки которого имеют свойства бактерии-родоначальника.
Отбор бактерий-трансформантов можно продемонстрировать, используя плазмиду pBR322 (см. рис. 5.10), содержащую два гена устойчивости к тетрациклину и ампициллину. Для отбора этих бактерий в агар добавляют антибиотик — или ампициллин, или тетрациклин в зависимости от того, какой из генов (Ыа или tet) остался интактным после введения чужеродной ДНК. На такой среде клоны образуют клетки только с плазмидами. Для отделения рекомбинантных бактерий часть материала каждого клона переносят на другую чашку Петри, содержащую антибиотик, ген устойчивости к которому был разрушен при создании рекомбинан- тов. На этих чашках Петри дают клоны только те бактерии, которые содержат исходную плазмиду, а рекомбинантные бактерии их не образуют. Такая тщательная селекция клонов по устойчивости к антибиотику позволяет идентифицировать рекомбинантные клоны. При поиске рекомбинантных клонов успешно применяют метод авторадиографии.
Дата добавления: 2016-02-09; просмотров: 1040;
