БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ 5 страница
В последние годы достигнуты большие успехи в расшифровке молекулярного механизма действия антибиотиков. Наиболее яркая особеннность антибиотиков — исключительная специфичность их действия. По выражению П. Эрлиха, антибиотики — это магические пули. Специфика действия их состоит в избирательном подавлении этими эффекторами одного или нескольких процессов лишь у некоторых микроорганизмов. Таким образом, антибиотики блокируют метаболические мишени в клетках-мишенях. В зависимости от специфики действия антибиотиков на молекулярном уровне различают следующие группы соединений, вызывающие у бактерий:
1) нарушение биосинтеза пептидогликанов клеточной стенки (пенициллины, ванкомицин, цефалоспорины);
2) нарушение отдельных этапов процессов трансляции (амфени- колы, аминогликозиды, тетрациклины, макролиды, линкосамиды);
3) повреждения цитоплазматической мембраны (грамицидин, полимиксины);
4) нарушение биосинтеза нуклеиновых кислот (рифамицины, актиномицин D, противоопухолевые антибиотики);
5) нарушение энергетического обмена (олигомицин, хлоргек- сидин).
Антибиотики широко используют в качестве молекулярных инструментов при исследовании фундаментальных проблем биологии, таких, как расшифровка тончайших механизмов биосинтеза белка, нуклеиновых кислот и структуры клеточных стенок бактерий, создание моделей транспорта ионов через биологические мембраны и др.
Изыскание новых антибиотиков обусловлено как потребностями практики, так и накоплением резистентных форм микроорганизмов по отношению ко многим антибиотикам. Устойчивость бактерий к пенициллинам и цефалоспоринам создает присутствующий в их клетках энзим лактамаза (пенициллиназа). Фермент гидролизует амидную связь (3-лактамного цикла в молекуле антибиотика с образованием пенициллиновой кислоты, которая полностью лишена антимикробной активности:
|
| О Н Пенициллиновая кислота |
| Пенициллин |
Специальное изучение объема и потенциала защитных свойств микроорганизмов показало, что их резистентность к антибиотикам имеет глобальный характер и обеспечивается как разнообразием фенотипов резистентности, так и разнообразием и стабильностью систем горизонтального генного транспорта. Поэтому главное направление получения новых антибиотиков состоит не в открытии новых соединений, а в химической трансформации природных молекул для создания полусинтетических антибиотиков, характеризующихся значительно меньшей резистентностью и токсичностью, но более широким спектром действия, большим временем жизни, химической и биологической устойчивостью. Важный подход на пути получения устойчивых аналогов антибиотиков — использование природных ингибиторов (3-лактамаз — кла- вулановой и оливановой кислот.
Методы получения антибиотиков путем химического синтеза чрезвычайно сложны и не могут конкурировать с их биосинтезом методами биотехнологии. Существует несколько способов получения как природных, так и полусинтетических антибиотиков. Направленный биосинтез антибиотиков осуществляется путем прямой ферментации микроорганизма — продуцента с подходящим
нии природы его ацильнои группировки при сохранении в неизменном виде ядра пенициллина — 6-аминопенициллановой кислоты (6-АПК). В промышленности 6-АПК получают путем гидролиза природных пенициллинов с помощью специфического фермента — пенициллинацилазы, образующейся с высоким выходом в процессе ферментации ряда штаммов микроорганизмов. Аци- лазы различают по их субстратной специфичности. Некоторые из ацилаз способны катализировать и обратные реакции — процессы ацилирования аминогруппы 6-АПК с образованием модифицированного пенициллина. Таким путем было получено более 40 ООО полусинтетических пенициллинов. Существенно, что во многих случаях 6-АПК не выделяют из культуральной жидкости, например при превращении бензилпенициллина в ампициллин:
| сн3 сн3 СООН |
| а |
| ch,-co-nh- |
0=с n Бензилпенициллин
|
| сн,-соон |
+ Н20, пенициллин- ацилаза
| n 6-АПК |
| h2n- 0=С |
сн3 сн3 СООН
Бензилпенициллин гидролизуют ацилазой мутанта Kluyvera citrophi- la при рН 7,8 — 8,0 и температуре 40—50 "С. Затем в ферментер вносят мутант Pseudomonas melanogenum и фенилглицин. Условия ферментации изменяют таким образом (рН 5,0 — 5,5), чтобы ацилаза второго мутантного организма осуществляла синтез ампициллина:
| СНз сн3 соон |
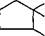
| 6-АПК |
nh2 1
| h,n- |
| Ацилаза -Н,0 |
| + |
| 0=с n |
Фенилглицин
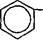
|
| nh2 I ch-co-nh- |
| сн3 сн3 соон |
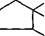
| Замена ацильного остатка приводит к синтезу других полусинтетических антибиотиков. Так, если RC^ в молекуле пеницил- О |
СН-СООН
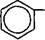
|
0=с n Ампициллин
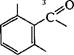
|
| осн |
| лина представлен |
| ОСН3 |
возникает метициллин, а в слу-
.О
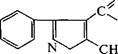
|
| чае ацила |
| — оксациллин. |
| О |
Антибиотики продуцируются плесневыми грибами, актиноми- цетами, эубактериями и другими микроорганизмами. Некоторые из этих организмов способны продуцировать большое количество антибиотиков. Так, 6 родов филаментозных грибов производят около 1000 различных антибиотиков, в том числе пенициллин и цефалоспорин, а три рода актиномицетов — 3000 антибиотиков. Среди актиномицетов наибольший вклад вносит род Streptomyces, один из видов которого — S. griseus синтезирует более 50 антибиотиков. В процессе образования антибиотиков задействовано значительное число генов. Массовая расшифровка первичной структуры геномов микроорганизмов показала, что эта величина равна 1 — 2%. Так, у Bacillus subtilis число таких генов достигает 2 %, что обеспечивает микроорганизму большие возможности для защиты и адаптации. С другой стороны, это обстоятельство затрудняет анализ путей биосинтеза антибиотиков и идентификацию отдельных мутаций, способных увеличить выход продукта. Тем не менее большинство известных в настоящее время высокопродуктивных штаммов продуцентов антибиотиков получено традиционными методами мутагенеза и селекции.
Биосинтез антибиотиков, как и любых других вторичных метаболитов, возрастает в фазе замедленного роста клеточной популяции (конец трофофазы) и достигает максимума в стационарной фазе (идиофазе). Считают, что в конце трофофазы изменяется энзи- матический статус клеток, появляются индукторы вторичного метаболизма, освобождающие гены вторичного метаболизма из-под влияния катаболитной репрессии. Поэтому любые механизмы, тормозящие клеточную пролиферацию и активный рост, стрессовые ситуации, активируют процесс образования антибиотиков.
Процесс культивирования идиолитов проходит две фазы (дву- степенчатое культивирование). На первой фазе происходит накопление достаточного количества биомассы, которая выращивается на среде для роста микроорганизма. Эта фаза должна быть быстрой, а питательная среда дешевой. На второй фазе осуществляются запуск и активный синтез антибиотика. На этой фазе ферментацию ведут на продуктивной среде.
Образование антибиотиков регулируется условиями культивирования микроорганизмов. Поэтому оптимизация питательной среды является главным фактором в повышении выхода продукта. - Специальные опыты показали, что выход цефалоспорина С уменьшается при переходе от использования в качестве источни-. ка углерода сахарозы к быстро усваиваемому углеводу глюкозе. Наиболее оптимальной средой для образования антибиотика культурой Streptomyces antibioticus оказалась смесь 0,1 % глюкозы и 1 % галактозы. При таком соотношении моносахаридов глюкоза быст-, ро утилизируется и микроорганизм переключается на усвоение»' галактозы, что и инициирует идиофазу.
Многие антибиотики берут свое начало от промежуточных соединений обмена первичных метаболитов, поэтому их биосинтез, регулируется путем ретроингибирования. Так, биосинтез пенициллина культурой гриба Penicillium chrysogenum контролируется по принципу обратной связи L-лизином. Этот эффект объясняется" тем, что биосинтез как пенициллина, так и лизина осуществляет-^ ся через общий предшественник — а-аминоадипиновую кислот/ (см. схему ниже). Торможение лизином первого фермента биосинтеза — гомоцитратсинтазы — приводит к недостатку а-аминоади пиновой кислоты, что снижает выход антибиотика.
Добавление в питательную среду а-аминоадипиновой кислоты предотвращает ингибирующий эффект лизина и активирует биосинтез пенициллина в отсутствие лизина. Кроме ретроингибирова-< ния биосинтез многих антибиотиков тормозится высокими концентрациями своих же антибиотиков. Следует отметить, что в процессе эволюции микроорганизмы выработали механизмы защиты от действия собственных антибиотиков. Эта проблема успешно решается,
в результате использования иммобилизованных ферментов.
| а-Кетоглутарат + Ацетил-КоА |
| . Гомоцитрат- синтаза |
| Гомоцитрат |
| Гомоизоцитрат |
| а-Аминоадипинат / \ / 4 / \ |
Большинство антибиотиков получают при глубинной аэробной ферментации периодического действия в асептически? условиях. Период ферментацт длится 7—10 суток. В последние годы внедряются полунепрерывные и непрерывньп. процессы ферментации. Технология завершающих стадии- процесса определяется приро дой антибиотика, характерол производства и целями дальнейшего использования антг- биотиков. Для медицински" ----- Лизин Бензилпенициллин целей технология выделения *
| Penicillium chrysogenum |
Отработанный Растворитель растворитель
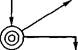 Первый экстрактор
Первый экстрактор
|
| Ротационный фильтр |
| Ферментер для роста культуры |
| Биореактор |
| Колонна для очистки |
Второй и третий экстракторы
| V |
| Промывка кристаллов |
| \ |
| гЧЕЗЭ- | Керам |
| Керамический фильтр |
Отработанный растворитель
Суспензия
-QSD-
Ленточный фильтр
| Испаритель |
Растворитель
V
Кристаллическая калиевая соль пенициллина
| Испаритель |
Центрифуга
| Растворитель |
IV
Фильтр
¥
Раствор гидрохлорида прокаина
РЬ I
очный! Г то * '
| Ленточный фильтр |
| Резервуар для смешения |
V
\ Сетчатый ^ фильтр
—Вакуум
Лиофильная сушка
Прокаиновая соль пенициллина
Рис. 3.6. Технологическая схема производства пенициллина (по B.Atkinson, F.Mavituna, 1983)
очистки имеет особое значение. Обычно она включает сложные многоступенчатые комбинации различных операций: экстракцию антибиотиков подходящими растворителями, осаждение и перекристаллизацию их из разных сред, фракционирование на ионообменных смолах, лиофильную и распылительную сушку готовых препаратов (рис. 3.6). Антибиотики выделяют или в виде сравнительно неочищенных препаратов (натриевая соль пенициллина), или в виде высокоочищенных веществ (прокаиновая соль пенициллина), предназначенных для клинического использования. Выход антибиотиков обычно составляет несколько десятков граммов на 1 л.
3.5.2. Получение промышленно важных стероидов
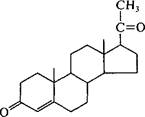 Прогестерон
Прогестерон
|
Способность клеток микроорганизмов к сложнейшим процессам биотрансформации наиболее полно реализовалась при получении промышленно важных стероидов. Использование абсолютной субстратной специфичности и стереоспецифичности биологических катализаторов, присущих целым клеткам микроорганизмов, позволило разработать условия осуществления множества химических реакций для структурных перестроек стероидов. В результате были получены новые соединения с лучшими фармакологическими свойствами. Биотрансформация стероидов обычно заключается в селективном воздействии на одно из положений стероидного скелета. Первый промышленный процесс микробной биотрансформации стероидов основывался на технологии направленного гидроксилирования (11-а-гидроксилирование) прогестерона:
 11-а-Гидроксипрогестерон
11-а-Гидроксипрогестерон
|
Значимость разработанной микробной трансформации определяется тем, что процессы гидроксилирования кортикостерона и его производных лежат в основе промышленного получения многих ценных продуктов: противовоспалительных и противоопухолевых препаратов, трансквилизаторов, анестезирующих средств, половых гормонов и пр.
Так, производство в промышленном масштабе важнейшего противовоспалительного препарата — преднизолона — осуществля
ется путем микробного гидроксилирования кортикостерона (см. схему ниже).
Правильность преобразования стероидного субстрата контролируют, сочетая химический подход со специфичностью биологической системы. Например, образование уксуснокислого эфира по С-17-субстрата стереохимически препятствует другим побочным реакциям.
Важнейший источник стероидных гормонов — культура клеток растений. Так, культура клеток диоскореи дельтовидной (Dioscorea deltoidea) корневого происхождения продуцирует фи- тостерин диосгенин и его гликозидные производиые (сапонины). Существенно, что способность к сверхсинтезу фуростаноловых гли- козидов ряда штаммов диоскореи, например штамма ДМ-ОГ, стабильно поддерживалась в течение 27 лет (Р. Г. Бутенко, 1999). Таким образом, культивирование клеток растений in vitro представляет собой новое решение проблемы промышленного получения вторичных метаболитов.
Дальнейшие успехи в производстве стероидных препаратов связывают с применением иммобилизованных клеток, использованием оптимального сочетания биологических и химических превращений, а также с совершенствованием технологии очистки получаемых соединений. Среды для биотрансформации имеют достаточно сложный состав, а реакция требует строгого контроля за каждым ее параметром (рН, время и т.д.). Так, среда для осуществления реакции окисления кортизола в пред- низолон культурой клеток Arthrobacter simplex включает пептон, глюкозу и кукурузный экстракт. Через сутки к смеси добавляют вещество S Рейхш- тейна. Процесс ведут строго в нейтральной среде при температуре 28 °С в течение 120 ч. Выход преднизолона составляет 93 %.
СН,ОН I
С=0
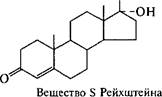 Curvularia lunata
Curvularia lunata
|
СН2ОН I
С=0
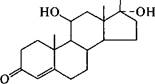 Кортизол
Arthrobacter simplex
Кортизол
Arthrobacter simplex
|
СН2ОН I
С=0
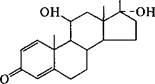 Преднизолон
Преднизолон
|
Разработка крупномасштабного производства преднизолона путем биотрансформации стероидов позволила снизить стоимость этого препарата в 200 раз.
Глава 4
БИОИНДУСТРИЯ ФЕРМЕНТОВ
4.1. ПРИМЕНЕНИЕ ФЕРМЕНТОВ
Ферменты сохраняют свои уникальные свойства (эффективность, специфичность действия) вне клеток, поэтому их традиционно широко применяют в практике. Биологические катализаторы нетоксичны, работают в мягких условиях, используют доступное сырье (в том числе и отходы), в связи с чем их применение в промышленности выгодно с экономической и экологической точек зрения.
По объему производства ферменты занимают третье место после аминокислот и антибиотиков. Из более чем 2000 известных в настоящее время ферментов в промышленности используется около 30. Основная часть ферментов, поступающих на мировой рынок, приходится на долю гидролаз, из которых 60 % составляют пептидогид- ролазы (в основном щелочные и нейтральные протеазы), использующиеся в качестве детергентов в производстве синтетических моющих средств, а 30 % — гликозидазы, применяющиеся в производстве кондитерских изделий, фруктовых и овощных соков. Ферменты находят применение в текстильной, кожевенной, целлюлозо- бумажной, медицинской, химической промышленности (табл. 4.1).
По прогнозам ученых, основным потребителем ферментов в ближайшем будущем остается пищевая промышленность. Главное место среди этих энзимов занимают глюкоизомераза и глюкоами- лаза, применяющиеся для приготовления обогащенных фруктозой кукурузных сиропов и составляющие около 50 % рынка пищевых энзиматических препаратов.
Все большее развитие получают технологические процессы с участием сложных энзиматических систем, включающих кофер- менты. Так, созданы ферментные мембранные реакторы, катализирующие непрерывные процессы с регенерацией НАДН (восстановительное аминирование кетокислот, восстановление а-ке- токислот в а-гидроксикислоты). Разработаны системы разделения рацематов посредством стереоспецифического активного транспорта. Например, мембрана, содержащая гексокиназу и фосфата-
Применение ферментов
| Название и шифр фермента |
| Источники фермента |
Химический и биотехнологический процессы. Область использования
Амилазы (КФЗ.2.1.1 КФ 3.2.1.2 КФ 3.2.1.3)
Глюкоизоме- раза
(КФ5.3.1.18)
Глкжоокси-
даза
(КФ 1.1.3.4) и каталаза (КФ 1.11.1.6)
Липазы (КФ 3.1.1.3)
Пектиназа (КФЗ.2.1.15)
Пептидогид- ролазы (КФ 3.4)
Бактерии, грибы (Bacillus sp., Aspergillus niger, A.oryzae)
Более 80 видов микроорганизмов (Bacillus sp., Streptomyces albus, S.griseus)
Penicillium chrysoge- num, P.casei, P. nigricans, P.notatum, P.vi- tak, Aspergillus niger, Corynebacterium ssp.)
Поджелудочные железы животных, семена растений, микроорганизмы (Candida lipolytica, Streptomyces flavogriseus, Aspergillus ssp., Saccharomyces lipolytica)
Многие микроорганизмы (Aspergillus ssp., Fusarium ssp., Peni- cillum ssp.H др.)
Поджелудочные железы и слизистая желудка животных; плоды, побеги, отходы переработки некоторых растений (дынное дерево, инжир, ананас), микроорганизмы (Bacillus ssp., Aspergillus ssp., Penicillium ssp., Streptomyces ssp., Pseu- domonasssp.)
Гидролиз крахмала до декстринов, мальтозы и глюкозы. Спиртовая, пивоваренная промышленность, хлебопечение, получение патоки, глюкозы
Изомеризация D-глюкозы в D-фруктозу. Кондитерская, ли- кероводочная, безалкогольная промышленность, хлебопечение
Удаление кислорода и глюкозы (из яичного порошка, мясных и других продуктов). Виноделие, пивоваренная, консервная, соковая и безалкогольная промышленность
Гидролиз жиров и масел. Пищевая, легкая, медицинская промышленность, сельское хозяйство, коммунальное хозяйство, бытовая химия
Гидролиз галактуронана, осветление вина и фруктовых соков
Лизис белка. Получение аминокислот, производство и получение сыра, мягчение мясных и рыбных изделий, вьщелка кожи, активизация пищеварения.Пивоварение, виноделие, хлебопечение, пищевая промышленность, сельское хозяйство, медицина
| Название и шифр фермента | Источники фермента | Химический и биотехнологический процессы. Область использования |
| Цел л юл азы (КФ 3.2.1.4) Фруктофура- нозидаза (КФ 3.2.1.26) | Микроорганизмы: Clostridium ssp., Trichoderma reesei, Т. viridae, Alternaria tenuis, Aspergillus oryzae, Fusarium culmorum Микроорганизмы: Aspergillus ssp., Penicillium ssp., Fusarium ssp., Cercospora beticola, Bacillus subtilis, E. coli, Saccharomyces cerevisiae, Streptococcus mutans | Гидролиз целлюлозы до глюкозы. Производство пищевых и кормовых белковых препаратов, этанола, глюкозо -фруктозных сиропов. Спиртовая, пивоваренная, пищеконцентратная промышленность, хлебопечение, кормопроизводство Инверсия сахарозы. Кондитерская, ликероводочная, безалкогольная промышленность, си- ропопроизводство |
зу, функционирует как насос, избирательно прокачивающий лишь D-глюкозу. Применение сопряженных ферментативных реакций с участием алкогольоксидазы и катал азы дрожжей Hansenulla polimorpha и формальдегиддисмутазы бактерии Pseudomonas putida позволило осуществить окисление метанола в муравьиную кислоту с выходом 88 — 94%. В промышленности большое будущее имеют ферменты, способные катализировать химические реакции в органической фазе, в частности липазы. Существенно, что каталитическая активность панкреатической липазы свиньи сохраняется при концентрации воды в реакционной среде, составляющей всего 0,015 %, и при температуре 100 "С. Препараты липазы используют для синтеза оптически чистых сложных эфиров и феромонов, применяющихся в парфюмерии и медицине.
Для деградации и модификации антропогенных органических соединений, поступающих в окружающую среду, используют ферменты разных классов и в том числе лакказу, лигниназу, тирози- назу, монооксигеназу, диоксигеназу и др. Перспективна для очистки сточных вод новая технология, основанная на использовании реакции пластеинообразования, открытой А.Я. Данилевским в 1886 г. Сущность работ Данилевского состоит в экспериментальном доказательстве обращения протеолиза и возможности синтеза белковоподобных веществ (пластеинов) под действием ряда про- теолитических ферментов. Сточные воды содержат аминокислоты и пептиды, концентрация которых возрастает в результате гидролиза белковых компонентов отходов под воздействием пептидогидролаз микроорганизмов. Данная технология, активно внедряющаяся во
Франции, нацелена на производство в промышленных масштабах кормовых белков из аминокислот и пептидов сточных вод.
Ферменты широко используют в медицине, например в заместительной терапии в составе лечебных препаратов. Пероральное введение фенилаланин-аммиак-лиазы снижает уровень фенила- ланина в крови при фенилкетонурии. Протеолитические ферменты, амилазу и липазу применяют при заболеваниях желудочно- кишечного тракта и печени. В последние годы накопились данные об эффективности применения протеиназ в энзимотерапии злокачественных новообразований. Это объясняется большей проницаемостью мембран раковых клеток для гидролитических ферментов в сравнении с нормальными клетками, благодаря чему опухолевые клетки быстро лизируются при введении смеси протеиназ (препарат «папайотин»), Протеолитические ферменты — плазмин и активирующие его стрептокиназу и урокиназу используют для растворения тромбов в кровеносных сосудах; коллагеназу — для рассасывания рубцовых образований; эластазу — для задержки развития атеросклероза; лизоцим — для лечения конъюнктивитов; дезоксирибонуклеазу из стрептококка (стрептодорназа) — для лечения заболеваний верхних дыхательных путей и роговицы глаза.
Важнейшую область применения ферментов в медицине составляет энзимодиагностика — тестирование патологии того или иного органа человека по уровню активности фермента или соотношению его множественных форм и изоферментов. Так, аспар- татаминотрансфераза, изоцитратдегидрогеназа, лактатдегидрогеназа и альдолаза служат для выявления инфаркта миокарда; аланина- минотрансфераза, аспартатаминотрансфераза и лактатдегидрогеназа — для диагностики заболеваний печени; глутамилтрансфера- за — для блокировки отторжения органов при их пересадке и т.д.
Таким образом, производство ферментных препаратов занимает одно из ведущих мест в современной биотехнологии и относится к тем ее отраслям, объем продукции которых постоянно растет, а сфера применения неуклонно расширяется. По объему производства ферментов доминируют страны Западной Европы. Резкий рост этой индустрии наблюдается в США и Японии.
4.2. ИСТОЧНИКИ ФЕРМЕНТОВ
Ферменты присущи всем живым существам, однако для их выделения используют те природные объекты, в которых содержание искомого энзима составляет не менее 1 %. Для крупномасштабного получения ферментов пригодны только некоторые растительные организмы на определенной фазе их развития (проросшее зерно различных злаков и бобовых, латекс и сок зеленой массы ряда растений), а также отдельные ткани и органы животных (поджелудочная железа, слизистая оболочка желудочно-ки- шечното тракта, сычуг крупного рогатого скота, семенники половозрелых животных). Практически неограниченный источник ферментов — микроорганизмы (бактерии, грибы, дрожжи), содержащие набор большинства известных в настоящее время энзимов, количество которых можно повысить в десятки и сотни раз методами мутагенеза, селекции и индукции биосинтеза.
4.3. ТЕХНОЛОГИЯ КУЛЬТИВИРОВАНИЯ МИКРООРГАНИЗМОВ - ПРОДУЦЕНТОВ ФЕРМЕНТОВ
В зависимости от источника технология получения ферментных препаратов имеет свои особенности. При извлечении ферментов из растительного сырья и животных тканей технология сводится к экстракции энзимов и очистке их от сопутствующих балластных веществ. Технология ферментных препаратов микробного происхождения более сложная, так как дополнительно включает этапы культивирования микроорганизмов — продуцентов ферментов, в том числе этапы получения посевного материала и производственной культуры соответствующего микроорганизма.
Для производства посевного материала используют исходный штамм продуцентов, получаемый из лабораторных чистых культур, который выращивают разными способами на предварительно стерилизованной твердой или жидкой питательной среде до определенного возраста. Посевной материал консервируют (высушиванием или хранением при низких температурах) вплоть до дальнейшего использования. Производственные культуры продуцента получают, выращивая посевной материал микроорганизмов как на поверхности твердых или жидких сред, так и в глубине жидких питательных сред.,
Дата добавления: 2016-02-09; просмотров: 1324;
