БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ 3 страница
Достижения в области молекулярной биологии и молекулярной генетики позволили биотехнологам начиная с 70-х годов прошедшего столетия перейти от слепого отбора штаммов мутантов к сознательному конструированию геномов, используя для этой цели прогрессивную технологию рекомбинантной ДНК.
Каждое из множества разнообразных веществ создается в клетке в строго необходимых для роста пропорциях в результате ферментативных реакций. Координация химических превращений. обеспечивающая экономность метаболизма, осуществляется у микроорганизмов тремя основными механизмами: регуляцией активности ферментов, в том числе путем ретроингибирования; регуляцией объема синтеза ферментов (индукция и репрессия биосинтеза ферментов); катаболитной репрессией.
| -ЦТ<Г |
В процессе ретроингибирования (ингибирование по принцип1 обратной связи) активность фермента, стоящего в начале многоступенчатого превращения субстрата, тормозится конечным ме таболитом, что детально разработано при изучении регуляции биосинтеза пиримидиновых нуклеотидов и новообразования ряда ами Нокислот:
Аспар-—► Карбамил—Дигидро- —Оротовая —»- Оротидин—►умФ.
тат аспартат оротовая кислота монофосфат
_ кислота
Карбамил-
трансфераза ----------------------------------------------------------------------
| Глутамат - |
| N-ацетил- ■ глутамат... |
Орнитин —- Цитруллин — Орнитин
Ацетил- трансфераза
Хоризмат —»-Антранилат...—»- Индолил- —►Триптофан
глицерофосфат
Антранилат-
синтетаза
Таким способом низкомолекулярные метаболиты передают информацию об уровне своей концентрации и состоянии обмена веществ ключевым ферментам метаболизма. Ключевые ферменты — это регуляторы периодичности в процессе функционирования энзима и соответственно образования продукта. Эта ферменты представле- НЬ1 в клетке аллостерическими белками, а конечные метаболиты — тдлостерическими эффекторами (активаторами и ингибиторами) ключевых энзимов. С помощью описанного механизма конечные продукты саморегулируют свой биосинтез. Ретроингибирование — способ точного и быстрого регулирования образования продукта.
На обмен веществ, аналогичный конечным метаболитам, оказывают эффект их аналоги (табл. 3.1). Указанное обстоятельство используется для селекции организмов с нарушением механизма обратной связи. Обход механизма ретроингибирования делает объект биотехнологического процесса нечувствительным к концентрации конечного продукта.
Таблица 3.1
Аналоги конечных метаболитов
|
Для отбора объектов продуценты выращивают на селективной среде, содержащей подходящий аналог или антиметаболит, которые не включаются в обмен веществ (в частности, аналоги аминокислот не включаются в состав белков), что ведет к подавлению роста организма. Выжившие мутанты обладают дефектами в механизме регуляции активности фермента по принципу обратной связи и поэтому служат важными объектами в обеспечении сверхсинтеза целевого продукта.
Среди тысяч энзимов, присущих микроорганизмам, одни, например ферменты гликолиза, синтезируются постоянно и их образование не зависит от состава питательной среды. Такие ферменты называют конститутивными. Другие энзимы, адаптивные или инду- цибельные, возникают только в ответ на появление в питательной среде индукторов — субстратов или их структурных аналогов. Так, Добавление (3-галактозида — лактозы к питательной среде, на которой культивируются клетки кишечной палочки Е. coli, вызывает мгновенное появление (3-галактозидазы в них, биосинтез которой в последующий период времени возрастает в 10000 раз. Установлено, что регуляция объема биосинтеза ферментов осуществляется на оперонном уровне (Ф.Жакоб и Ж. Моно, 1961) путем изменения количества иРНК, образующихся в процессе транскрипции.
Опероном называется упорядоченная совокупность структурных генов (со знаками начала и конца) и регуляторных участков. В состав регуляторной зоны оперона входят ген-регулятор, промотор, усилители транскрипции (энхансеры), ослабители транскрипции (сайлансеры) и другие компоненты.
В процессе индукции низкомолекулярный метаболит-индуктор (например, лактоза), соединяясь с репрессорным белком (продукт гена-регулятора), инактивирует его и тем самым препятствует взаимодействию белка-репрессора с зоной оператора, что обеспечивает возможность присоединения к промотору РНК-полиме- разы и начало синтеза иРНК.
Изучение механизма регуляции новообразования аминокислот у микроорганизмов показало, что конечные продукты метаболических путей не только ингибируют активность ферментов первых стадий процесса, но и тормозят биосинтез ферментов последних его этапов. Таким образом, помимо аминокислот у микроорганизмов регулируется новообразование многих первичных метаболитов (пури- новых и пиримидиновых нуклеотидов, витаминов и других соединений). Обнаруженный феномен был назван репрессией, а ферменты, биосинтез которых стопорится под влиянием низкомолекулярных метаболитов, переводящих репрессорный белок в активную форму, способную оккупировать зону первоначального связывания РНК-полимеразы (оператор), называются репрессибельными. К их числу относятся глутаминсинтетаза, триптофансинтетаза, орнитин- карбамилтрансфераза, уреаза и ряд других энзимов. Специально поставленные опыты продемонстрировали, что репрессия биосинтеза ферментов обеспечивает более грубую в сравнении с ретро- ингибированием регуляцию образования анаболических энзимов Если концентрация конечного продукта уменьшается до определенного очень низкого уровня, то происходит дерепрессия фермента, т. е. скорость их биосинтеза возрастает до необходимых величин Бактериальные клетки продуцируют множество низкомолекулярных эффекторов в ответ на изменение окружающей средь: (стресс, голодание, действие фагов и пр.). Каждый из эффекторов, взаимодействуя по аллостерическому механизму с определенными регуляторными белками, моделирует промоторную специфичность РНК-полимеразы, запуская тем самым экспрессию определенного набора генов.
Таким образом, ведущими механизмами, обеспечивающим! экономность образования продуктов в клетках микроорганизмоь являются ретроингибирование и репрессия, базирующиеся н принципе обратной связи.
Если в питательной среде присутствуют несколько различны источников углерода, клетка микроорганизма вырабатывает фег-
Структурные гены (1ас-гены) Оператор (О)
| Промотор (Р) |
Ген-регулятор (R)
| Т |
| т |
| Ж |
ДНК I
Транскрипция^
рнк-
| Субъединица белка-репрессора |
полимераза
Репрессия
|
| иРНК для белка- репрессора |
| Трансляция |
Активный репресор (тетрамер) А
| О |
| R |
| Г |
| 1----- Г |
| днкх |
X Y I
|
цАМФ • БАК
Полицистронная иРНК ♦
|
| S |
| ЛА |
| БЕЛ КИ |
Лактоза \> </ Индукция^р (индуктор)
Комплекс индуктора с неактивным репрессором
Рис. 3.2. Структура и механизм индукции и репрессии 1ас-оперона (пояснения в тексте):
А — в отсутствие индуктора; Б — в присутствии индуктора и при дефиците
глюкозы
менты для усвоения лишь одного, наиболее предпочтительного субстрата. Так, когда клетки выращивают на смеси глюкозы и лактозы, то в первую очередь утилизируется глюкоза. После полного исчерпания глюкозы происходит экспрессия ферментов метаболизма лактозы (экспрессия структурных генов лактозного оперона). Это явление получило название катаболитной репрессии, так как ранее полагали, что причина его состоит в подавлении биосинтеза ферментов обмена лактозы продуктами катаболизма глюкозы.
ноМ питании. Чем ближе обе величины, тем выше качество белка. 5епки яйца и молока обладают высокой пищевой ценностью и используются в качестве эталона при оценке других белков. Мно- гне белки растительного происхождения характеризуются дефицитом некоторых незаменимых аминокислот. Так, белки пшеницы и риса обеднены лизином и треонином, а белки кукурузы — пизином и триптофаном.
Введение синтетических незаменимых аминокислот в кормовые концентраты позволяет балансировать корма сельскохозяйственных животных по уровню белка. При добавлении 2 —4 дефицитных аминокислот к 1 т комбикорма общий расход кормов уменьшается на 15 — 20 %, выход продукции увеличивается на 20 %. Добавление к кормам аминокислот способствует переводу животноводства на промышленную основу. Данные о потребности некоторых сельскохозяйственных животных в незаменимых аминокислотах приведены в табл. 3.3.
Таблица 3.3
Потребность ряда сельскохозяйственных животных в незаменимых аминокислотах ( % к сырому протеину)
|
Помимо применения в качестве пищевых добавок, приправ и усилителей вкуса аминокислоты используют как сырье в химической, парфюмерной и фармацевтической промышленности и при производстве ряда других веществ:
глицин — подсластитель, антиоксидант, бактериостатик; аспарагиновая кислота — усилитель вкуса, сырье для синтеза асгтартама;
глутаминовая кислота — усилитель вкуса, препарат для лечения психических заболеваний;
гистидин — противовоспалительное средство; метионин — пищевая и кормовая добавки; цистеин — фармацевтический препарат; треонин и триптофан — пищевые и кормовые добавки; фенилаланин — сырье для получения аспартама; лизин — пищевая и кормовая добавки, сырье для получения искусственных волокон и пленок.
В промышленных масштабах белковые аминокислоты получают:
1) гидролизом природного белоксодержащего сырья;
2) химическим синтезом;
3) микробиологическим синтезом;
4) биотрансформацией предшественников аминокислот с помощью микроорганизмов или выделенных из них ферментов (химико-микробиологический метод).
При гидролизе белоксодержащее сырье (отходы пищевой и молочной промышленности) нагревают с растворами кислот или щелочей при температуре 100 —105 °С в течение 20—48 ч. Чаще всего используют 20 %-й раствор соляной кислоты, обеспечивающий глубокий гидролиз белка. Кроме того, для ускорения реакции гидролиза белков используют иммобилизованные протеолитические ферменты и ионообменные смолы. В ходе кислотного гидролиза белков происходят рацемизация и разрушение некоторых составляющих их аминокислот. При кислотном гидролизе полностью разрушается триптофан и достаточно значительны потери цистеина, метиони- на и тирозина (10—30%). Лучшим способом уменьшения потерь аминокислот при гидролизе является проведение его в вакууме или в атмосфере инертного газа, а также соблюдение высокого соотношения количества кислоты, взятой для гидролиза, и массы белка (200:1). Рациональное использование сырья при гидролизе, характерное для многих других биотехнологических производств, обеспечивает создание безотходных технологий и способствует оздоровлению окружающей среды. Ранее методом гидролиза получали аминокислоты исключительно для фармацевтических и научных целей. В последнее время сфера использования белковых гидролиза- тов существенно расширилась. Их применяют в медицине, животноводстве, пищевой и микробиологической промышленности.
Существенный недостаток методов химического синтеза аминокислот состоит в получении целевых препаратов в виде рацемической смеси D- и L-стереоизомерных форм. Подавляющее большинство природных аминокислот относится к L-ряду. D-a-ами- нокислоты обнаружены лишь в составе гликопротеинов клеточных стенок бактерий, антибиотиков и некоторых токсинов. Проницаемость L-аминокислот в клетке в 500 раз превышает таковук: ее антипода. Стереоспецифичны также транспорт и метаболиз\ аминокислот. Исключением в этом отношении является лишь метионин, метаболизм которого нестереоизбирателен, благодаря чемл данная аминокислота получается преимущественно путем химического синтеза. Разделение рацематов других аминокислот — дорогая и чрезвычайно трудоемкая процедура.
Наиболее перспективен и экономически выгоден микробиологический синтез аминокислот. Более 60 % всех производимых в нь стоящее время промышленностью высокоочищенных препаратов белковых аминокислот получают именно этим способом, главно- преимущество которого в сравнении с методами химического сиг- теза состоит в возможности получения L-аминокислот на основ возобновляемого сырья.
В последние годы при производстве аминокислот все шире используют биотрансформацию предшественников аминокислот, особенно с помощью иммобилизованных ферментов или клеток микроорганизмов, предварительно получаемых химическим путем.
Промышленное производство аминокислот стало возможным после открытия способности у некоторых микроорганизмов выделять в культуральную среду значительные количества какой-либо одной аминокислоты (С. Киносита, 1955). При этом было подмечено, что большинство из нескольких тысяч проанализированных диких штаммов микроорганизмов продуцировали аминокислоты во внешнюю среду, но в очень незначительных количествах. Не зафиксировано никакой связи между таксономическим положением микроорганизма и способностью к продуцированию той или иной аминокислоты. Так, среди возможных продуцентов глутами- новой кислоты отмечены организмы, из которых 30 % — дрожжи, 30% — стрептомицеты, 20% — бактерии и 10% — микроскопические грибы. И лишь один из обследованных штаммов микроорганизмов — Corynebacterium glutamicum был способен к сверхсинтезу глутамата. Этот штамм использовали при организации первого в мире крупномасштабного производства глутаминовой кислоты микробиологическим методом в Токио (1956). В России изыскания в области промышленного синтеза аминокислот были начаты в 50-х годах прошлого столетия по инициативе акад. А. А. Александрова.
Перспективные штаммы продуцентов постоянно улучшают посредством селекции мутантов с измененной генетической программой и регуляторными свойствами. Распространенные объекты селекции продуцентов — микроорганизмы, относящиеся к родам Brevibacterium, Micrococcus, Corynebacterium, Arthrobacter (табл. 3.4).
Таблица 3.4
Микроорганизмы — продуценты аминокислот
(по Н. Б. Градовой и О. А. Решетник, 1987)
|
| Аминокислота | Микроорганизмы |
| Треонин Триптофан Тирозин Валин | В. flavum, С. glutamicum, Arthrobacter parafmens, Е. coli, S. marcescens Micrococcus, Candida utils, B. subtilis B. flavum, C. glutamicum B. flavum, C. glutamicum |
Разработка технологической схемы получения отдельной аминокислоты полностью базируется на знании путей и механизмов регуляции биосинтеза конкретной аминокислоты. Необходимого дисбаланса метаболизма, обеспечивающего сверхсинтез целевого продукта, добиваются путем строго контролируемых изменений состава и условий среды.
Микробиологические методы производства аминокислот
Производство лизина. По содержанию лизина наименее сбалансированы белки злаковых культур, у которых его дефицит составляет от 20 до 50 %. На территории России недостаток лизина в кормах не может быть восполнен за счет сои, поэтому в нашей стране производство этой аминокислоты было организовано первым. Для удовлетворения потребностей животноводства в лизине крупнотоннажное производство налажено в Испании, Франции, Японии и США.
В клетках микроорганизмов лизин синтезируется из аспараги- новой кислоты и служит конечным продуктом разветвленного метаболического пути биосинтеза, общего для трех аминокислот — лизина, метионина и треонина (рис. 3.3).
Таким образом, в процессе новообразования аминокислот из общего предшественника одновременно с лизином возникают две другие аминокислоты — метионин и треонин. В этом случае эффекта накопления в среде всего одной целевой аминокислоты добиваются путем блокирования процессов, ведущих к синтезу побочных аминокислот, возникающих в связи с разветвлением метаболического путк
Образование лизина в клетке бактерии находится под строги\ метаболическим контролем. У типичных продуцентов L-лизина — Brevibacterium flavum и Corynebacterium glutamicum — фермент ас- партаткиназа, открывающий метаболический путь, является алло- стерическим белком, чувствительным к ингибированию по принципу обратной связи при совместном и согласованном действие побочных продуктов L-треонина и L-лизина. При накоплении тре онина и лизина в избыточной концентрации ингибируется аспаг- таткиназа и их синтез останавливается, при пониженной концентрации любой из двух аминокислот процесс активизируется.
Чтобы добиться образования лизина в больших количества: получают мутанты двух типов. У мутантов первого типа не синтез!"
|
| Гомосерин дегидрогеназ; |
| Гомосерин |

|
| Цистатионин |
| I |
| Гомоцистеин |
| Гомоцистеин Треонин |
Аспартат
+ АТФ | Аспартаткиназа Фосфоаспартат
Полуальдегид аспартата
\
Дигидропиколиновая кислота
а,5-Диаминопиме- ли новая кислота
Лизин
Метионин
Рис. 3.3. Схема биосинтеза лизина, метионина и треонина в клетках Corynebacterium glutamicum и Brevibacterium flavum: —»• — ингибирование по принципу обратной связи
руется или не функционирует гомосериндегидрогеназа, в результате чего блокируется синтез метионина и треонина. Такие мутанты являются ауксотрофами по гомосерину или треонину (метионину); внутриклеточная концентрация треонина у них существенно снижена, что снимает блокаду с аспартаткиназы. Поэтому при выращивании мутантных штаммов в среде, где присутствуют лимитирующие концентрации метионина и треонина, они способны образовывать избыточные количества лизина. Мутанты второго типа дефектны по структурному гену, детерминирующему конформа- цию аспартаткиназы. В итоге фермент теряет чувствительность к высоким концентрациям аллостерического ингибитора — лизина.
Важный фактор, обеспечивающий в культуральной среде высокие концентрации аминокислоты, синтезированной внутри клетки, — проницаемость клеточных мембран. Проницаемость клеточной мембраны увеличивают либо с помощью мутаций, либо путем изменения состава питательной среды. В последнем случае в культуральной среде создают дефицит биотина (1 — 5 мкл/л), добавляют пенициллин (2 — 4 мкг/л), детергенты (твин-40 и твин- 60) или производные высших жирных кислот (пальмитаты, стеа- Раты). Биотин контролирует содержание в клеточной мембране фосфолипидов, а пенициллин нарушает биосинтез клеточных стенок бактерий, что повышает выделение аминокислот в среду.
Для культивирования штаммов микроорганизмов при производстве аминокислот как источники углерода наиболее доступны Углеводы — глюкоза, сахароза и реже фруктоза и мальтоза. Для снижения стоимости питательной среды в качестве источников
углерода используют вторичное сырье: свекловичную мелассу, молочную сыворотку, гидролизаты крахмала, сульфитные щелока. Технология этого процесса совершенствуется в направлении разработки дешевых синтетических питательных сред на основе уксусной кислоты (до 1,5%), пропионовой кислоты, метанола, этанола (до 1 %) и н-парафинов. В качестве источников азота применяют мочевину и соли аммония (сульфаты и фосфаты). Для успешного развития микроорганизмы нуждаются в стимуляторах роста, в качестве которых выступают экстракты кукурузы, дрожжей и солодовых ростков, гидролизаты отрубей и дрожжей, витамины группы В. Кроме того, в питательную среду добавляют необходимые для жизнедеятельности макро- и микроэлементы (Р, Са, Mg, Мп, Fe и др.). На процесс биосинтеза аминокислот существенное влияние оказывает снабжение воздухом, при этом степень аэрации индивидуальна для производства каждой конкретной аминокислоты. Стерильный воздух подается специальными турбинными мешалками (рис. 3.4). Опыты показали, что лизин появляется в культуральной среде начиная с середины экспоненциальной фазы роста культуры клеток микроорганизма и достигает максимума к ее концу. Поэтому на первой стадии технологического процесса формируют биомассу продуцента, которую выращивают в специальных посевных аппаратах в течение суток (рН 7,0 — 7,2; температура 28 — 30 °С), а затем подают в производственный ферментер, заполненный питательной средой. Лизин начинает поступать в культуральную жидкость через 25 — 30 ч после начала ферментации. По завершении процесса ферментации (через 55 — 72 ч) жидкую фазу отделяют от культуры клеток микроорганизма фильтрованием и используют для выделения из нее лизина.
Высокоочищенные препараты лизина получают после фракционирования фильтрата культуральной жидкости методом ионообменной хроматографии на катеоните. С этой целью лизин переводят в форму катиона:
H3N—СН— СООН I
(СН2)4
I
NH3
Для данного процесса фильтрат обрабатывают соляной кислотой до рН 1,6—2,0 (рН < рК,). Обладая двумя положительно заряженными ионогенными группировками, лизин прочно сорбируется на смоле и элюируется с нее в виде индивидуального соединения 0,5 — 5 %-м раствором гидроксида аммония после выхода всех других катионов. Элюат концентрируют в вакууме при температуре 60 °С, переводят в форму монохлоргидрата, после чего высушивают и дополнительно чистят с помощью перекристаллизации. В ре-
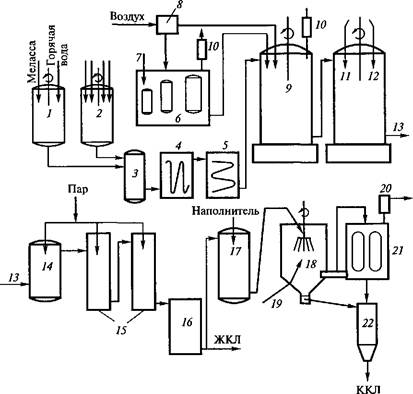 Рис. 3.4. Технологическая схема получения кормовых препаратов лизина (по B.C.Шевелухе и др., 1998):
1 — подача свекловичной мелассы; 2 — водная суспензия кукурузного экстракта и питательных солей; 3 — нагревательная колонка; 4, 5 — теплообменники; 6 — посевные аппараты; 7 — подача посевного материала; 8 — система фильтров для очистки и стерилизации воздуха; 9 — ферментер; 10 — фильтры для очистки отходящих газов; 11 — получение монохлоридгидрата лизина; 12 — подача соляной кислоты; 13, 14 — выход и подогрев монохлоридгидрата лизина; 15 — выпа- ривательная установка; 16 — сборник ЖКЛ; 17 — смешивание ЖКЛ с наполнителем; 18 — распылитель; 19— подача горячего воздуха; 20— очиститель воздуха; 21 — отделение сухого препарата лизина от воздуха; 22 — приемник ККЛ
Рис. 3.4. Технологическая схема получения кормовых препаратов лизина (по B.C.Шевелухе и др., 1998):
1 — подача свекловичной мелассы; 2 — водная суспензия кукурузного экстракта и питательных солей; 3 — нагревательная колонка; 4, 5 — теплообменники; 6 — посевные аппараты; 7 — подача посевного материала; 8 — система фильтров для очистки и стерилизации воздуха; 9 — ферментер; 10 — фильтры для очистки отходящих газов; 11 — получение монохлоридгидрата лизина; 12 — подача соляной кислоты; 13, 14 — выход и подогрев монохлоридгидрата лизина; 15 — выпа- ривательная установка; 16 — сборник ЖКЛ; 17 — смешивание ЖКЛ с наполнителем; 18 — распылитель; 19— подача горячего воздуха; 20— очиститель воздуха; 21 — отделение сухого препарата лизина от воздуха; 22 — приемник ККЛ
|
зультате получают препараты кристаллического лизина 97 — 98 %-й чистоты, которые используют для повышения питательной ценности пищевых продуктов и в медицинской промышленности.
Кроме высокоочищенных препаратов лизина получают иные виды его товарной формы: жидкий концентрат лизина (ЖКЛ), сухой кормовой концентрат лизина (ККЛ) и высококонцентрированные кормовые препараты, характеризующиеся относительно меньшей степенью очистки в сравнении с первым препаратом.
Второй по значимости незаменимой аминокислотой для питания человека и животных является метионин, который получают преимущественно путем химического синтеза, что экономически более выгодно в сравнении с микробиологическим способом.
Производство триптофана. Триптофан достаточно часто является лимитирующим фактором питания, так как его содержание в традиционных продуктах (рыба, молоко, кормовые дрожжи) в 3 раза ниже, чем в стандартном белке.
Подобно лизину триптофан образуется в ходе разветвленного метаболического пути, поэтому для его производства используют ауксотрофных мутантов, у которых блокированы реакции, ведущие к синтезу фенилаланина и тирозина. Однако при выращивании мутантных штаммов в среде с минимальной концентрацией этих аминокислот, не вызывающей регуляторных эффектов, избыточное накопление триптофана в среде не наблюдается, что объясняется особенностью процессов регуляции биосинтеза триптофана у микроорганизмов.
Наряду с другими ароматическими аминокислотами у микроорганизмов (подобно большинству организмов) триптофан образуется из метаболитов углеводного обмена — эритрозо-4-фосфата и фосфоенолпирувата.
Процесс новообразования ароматических аминокислот идет через шикимовую и хоризмовую кислоты. Метаболическим предшественником триптофана служит антраниловая кислота, которая возникает из хоризмовой кислоты под действием антранилат- синтетазы. Триптофан оказывает ингибирующее действие на ант- ранилатсинтетазу, поэтому для обхода метаболического контроля синтез фермента индуцируют ступенчатым введением предшественника — антраниловой кислоты (0,1 — 0,3 %):
Фосфоенолпируват + Эритрозо-4-фосфат
I
5-Дигидрохинная кислота
Шикимовая кислота
Хоризмовая кислота
 Фенилаланин
Фенилаланин
|
| Префеновая^^ Антраниловая кислота кислота |
| Фенилпируват и-Оксифенил- Триптофан |
| пируват |
| I |
Антрани л атсинтетаза -«-
Дата добавления: 2016-02-09; просмотров: 1143;
