БИОТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ В ПИЩЕВОЙ ПРОМЫШЛЕННОСТИ 6 страница
Поверхностный метод выращивания продуцентов, предложенный И.Такамине еще в 1894 г., состоит в культивировании микроорганизмов на поверхности увлажненных стерилизованных отрубей,« размещенных в кюветах, к которым иногда добавляют солодовые" ростки, древесные опилки, свекловичный жом. Инкубацию микроор-i ганизмов ведут в специальном термостатируемом цехе при постен янном контроле в нем температуры, влажности и подачи воздуха. \
В последние 15 лет для выращивания продуцентов ферментов; чаще используют более экономный — глубинный метод культиви-1 рования (рис. 4.1). В промышленных условиях для этих целей при^ меняют ферментеры из нержавеющей стали, снабженные при-! способлениями для перемешивания и подачи в жидкую питатель! ную среду стерильного воздуха. Сначала ферментер заполняют пи| тательной средой, автоклавируют, а затем засевают чистой куль! турой, подаваемой из специального генератора. Для предотвраще! ния инфекции в ферментере поддерживают повышенное давле>|
Воздух
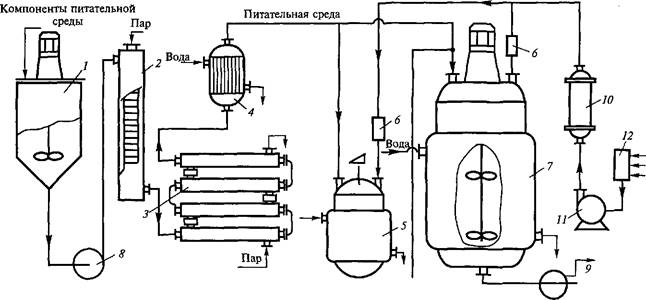 Рис. 4.1. Принципиальная технологическая схема глубинного культивирования микроорганизмов
(по А.А.Свитцову и др., 1986):
Рис. 4.1. Принципиальная технологическая схема глубинного культивирования микроорганизмов
(по А.А.Свитцову и др., 1986):
|
смеситель питательной среды; 2 — стерилизатор в непрерывном режиме потока питательной среды; 3, 4 — теплообменники; 5 — посевные аппараты; б, 10, 12 — фильтры для очистки воздуха; 7 — ферментер; 8, 9 — насосы; 11 — компрессор
ние наряду с оптимальными значениями рН, температуры, ре- докс-потенциала и другими условиями культивирования.
В настоящее время наиболее прогрессивным признан проточный метод культивирования микроорганизмов, который обеспечивает непрерывную подачу в ферментер как питательной среды, так и посевного материала. Размножение микроорганизмов и биосинтез фермента регулируют при использовании этого метода по мере поступления питательной смеси в ферментер. Такой ферментер представляет собой вращающийся трубкообразный реактор, через один конец которого в него поступает питательная среда и культура микроорганизмов, а из другого — выводятся ферменты, продукты жизнедеятельности и бактериальная масса. Основное достоинство метода — возможность длительное время поддерживать в автоматическом режиме рост культуры микроорганизма. Например, культура ацетонобутиловых бактерий находилась в таком реакторе в состоянии непрерывного размножения в течение 200 суток (И.Д.Иерусалимский с сотр., 1986).
Важнейшим фактором эффективности технологии ферментных препаратов является качество питательной среды. Основное требование к качеству питательной среды состоит в полноценности ее состава, обеспечивающей рост продуцента и биосинтез целевого фермента. Микроорганизмы нуждаются прежде всего в соединениях, содержащих углерод, азот, водород и кислород. К ним относятся органические вещества, соли аммония и вода. Кроме того, в состав питательной среды должны быть включены минеральные соединения, содержащие Mg, Са, Р, S, Fe, К и другие макро- и микроэлементы, витамины, ростовые вещества (биотин, инозит) и пр. Питательные среды в зависимости от состава делятся на синтетические и комплексные. Синтетическими считают те среды, которые состоят из определенного по качественному и количественному составу набора индивидуальных веществ. В комплексные среды входят различные природные продукты, часто отходы пищевых производств. К их числу относятся различные жмыхи, барда спиртовых заводов, картофельная мезга, кукурузный экстракт, меласса, отруби и прочие продукты. Благодаря использованию отходов комплексные питательные среды доступны, дешевы и обеспечивают безотходность биотехнологических производств.
4.4. ТЕХНОЛОГИЯ ВЫДЕЛЕНИЯ И ОЧИСТКИ ФЕРМЕНТНЫХ ПРЕПАРАТОВ
Выделение и очистка фермента как из культуры микроорганизма (выращенного любым способом), так и из других природных источников весьма трудоемкая и дорогостоящая процедура, поэтому, если фермент можно использовать в виде неочищенного препарата, его не очищают. В промышленности широко применяют коммерческие препараты ферментов, чистота которых составляет всего 0,1 % (т.е. 99,9 % составляют примеси). К таким отраслям относятся спиртовая, кожевенная, текстильная промышленность, а также сельское хозяйство, производство бытовой химии. Например, ферментный препарат, употребляемый в пивоварении, представляет собой высушенную биомассу плесневых грибов. В большинстве отраслей пищевой промышленности, практике научных исследований и особенно в медицине используют только очищенные препараты ферментов, частично или полностью освобожденные от балластных веществ и полностью охарактеризованные в отношении их специфичности и физико-химических свойств. Исходным материалом для получения препаратов ферментов служат: биомасса продуцента, фильтрат культуральной жидкости, экстракт из культуры микроорганизма или из тканей и органов растений и животных, из которых готовят препараты различной степени очистки.
Неочищенные ферментные препараты получают путем высушивания в мягком режиме культуры микроорганизмов вместе с остатками питательной среды. Такие препараты получают и путем упаривания экстракта из культуры продуцента, выращенного поверхностным способом, или из фильтрата культуральной жидкости (в случае глубинного выращивания микроорганизмов). Распространен также метод ацетоновых порошков, состоящий в осаждении и быстром обезвоживании при температуре не выше -10 °С тканей или вытяжек из них, содержащих ферменты. Технические препараты ферментов представляют собой либо высушенные до порошкообразного состояния продукты, либо жидкие концентраты, обычно характеризующиеся 50 %-м содержанием сухой массы веществ.
Для успешного выделения ферментов из клеточного содержимого необходимо очень тонкое измельчение исходного материала вплоть до разрушения субклеточных структур: лизосом, митохондрий, ядер и др., которые имеют в своем составе многие индивидуальные ферменты. Для этого используют специальные мельницы и гомогенизаторы, а также ультразвук, метод попеременного замораживания и оттаивания ткани. Для высвобождения ферментов из мембранных структур клетки к гомогенатам добавляют небольшие количества детергентов (твин, тритон Х-100) или обрабатывают их энзимами — лизоцимом, целлюлазой, лецитиназой С. Особое внимание при выделении ферментов уделяют проведению всех операций в условиях, исключающих денатурацию белка (нейтральные значения рН, стабилизирующие добавки в виде белков, солей и специальных соединений).
Пример, иллюстрирующий получение частично очищенного препарата (3-галактозидазы из мутанта Е. coli, представлен на рис. 4.2. Схема очистки включает отделение клеток микроорганизма по
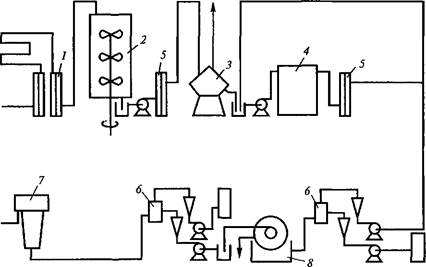 Рис. 4.2. Технологическая схема непрерывного получения Р-галактози- дазы из клеток Е. coli ML308 (по P.P.Gray et al., 1972):
1 — стерилизатор среды; 2— ферментер; 3, 7 — центрифуги; 4 — гомогенизатор; 5 — теплообменник; 6 — смесительные камеры; 8 — ротационный вакуум-фильтр
Рис. 4.2. Технологическая схема непрерывного получения Р-галактози- дазы из клеток Е. coli ML308 (по P.P.Gray et al., 1972):
1 — стерилизатор среды; 2— ферментер; 3, 7 — центрифуги; 4 — гомогенизатор; 5 — теплообменник; 6 — смесительные камеры; 8 — ротационный вакуум-фильтр
|
выходе их из ферментера от культуральной жидкости посредством центрифугирования и последующее разрушение клеток в гомогенизаторе высокого давления. Для освобождения белков от нуклеиновых кислот полученный гомогенат обрабатывают сульфатом марганца до конечной концентрации этой соли в смеси, равной 0,05 М. Осадок нуклеиновых кислот отделяется с помощью ротационной вакуум-фильтрации, а в образовавшийся фильтрат добавляют сульфат аммония до 45 % от его насыщения. Возникший осадок белков, содержащий |3-галактозидазу, собирают с помощью центрифугирования или вакуум-фильтрации. Вся процедура очистки энзима от момента подачи бактерий в систему до момента получения осадка (3-галактозидазы занимает всего 1 ч.
В зависимости от свойств выделяемого фермента и сопутствующих ему балластных веществ при получении очищенных препаратов ферментов комбинируют различные приемы и методы (рис. 4.3), такие, как термическое фракционирование, осаждение органическими растворителями, солями и тяжелыми металлами, фильтрация на молекулярных ситах, ионообменная хроматография, электрофорез, изоэлектрофокусирование.
На заключительных этапах очистки часто используют аффинную хроматографию (биоспецифическая хроматография, хроматография по сродству), которая основана на способности ферментов избирательно связывать те или иные лиганды — субстраты,
Фильтрование Концентрирование Осаждение
Вспомогательный Ацетон, спирт,
| Источники фермента |
| Сушка |
| Стандартизация, стабилизация |
| Экстракция Вода |
| Железы животных Растительные ткани_______ |
фильтрующий (NH4)2S04
| £ |
| ___ i |
| Фильтр- пресс |
| Растительный экстракт |
материал
Вакуумный концентратор
| рСолодиль- ник |
| Обратный] осмос |
| Вращающийся [барабан_____ |
| Ротационный вакуум-фильтр |
| Стабилизаторы, консерванты |
Рост микроорганизмов
Вода
Поверхностная [культура
-| Экстрактор
Вспомогательный фильтрующий, материал | f)*|
Емкостный |биореактор
Инертные г ингредиенты J>
Смеситель
\ I
L_J__ I
| Стабилизирующие соли, инертные ингредиенты |
| Смеситель |
Центрифуга
Лотковая сушилка
I Распылительная _ сушилка
Шаровая мельница или молотковая дробилка
Электрофорез, хроматография
Сушилка
Сухой неочи- щенный фермент
Разбавленный раствор очищен-1 ного фермента
Концентрированный раствор очищенного фермента
Фракционированный фермент (для специальных целей)
Стандартизованный фермент (сухой)
| оо |
Рис. 4.3. Схема получения ферментных препаратов из культур микроорганизмов (по Дж. Бейли, Д. Оллис, 1989)
коферменты, конкурентные ингибиторы, аллостерические эффекторы и т.п. Такое связывание весьма специфично (Кх Ю-4 М), что позволяет выделить тот или иной энзим из множества других белков. Например, из желудочного сока человека методом одноэтап- ной аффинной хроматографии выделена кислая липаза, использующаяся в заместительной терапии при заболеваниях печени.
Для синтеза аффинного сорбента, соответствующего специфичности данного фермента, лиганд (субстрат или его аналог) присоединяют к инертной матрице (макропористые гидрофильные гели, синтетические полимеры, неорганические носители). Для уменьшения пространственных трудностей при взаимодействии фермента с матрицей лиганд присоединяют к носителю через промежуточное звено (вставку, ножку, спейсер). Присоединение ли- гандов к поперечносшитой агарозе — сефарозе обычно проводят, активируя ее бромцианом (см. с. 91). Связывание с сефарозой, активированной бромцианом, л-амино-бензилянтарной кислотой, используемой в качестве лиганда, обеспечивает взаимодействие сорбента с каталитическим центром только карбоксипептидаз благодаря сходству лиганда с субстратами карбоксипептидазы:
—со—NH-CH-COOH НО-СО-СН-СН-СООН
 Матрица—О—С—NH II О
С-концевой остаток Аффинный сорбент с лигандом.
фенилаланина в субстрате Бензилянтарная кислота изостерична
карбоксипептидазы структуре остатка фенилаланина
Матрица—О—С—NH II О
С-концевой остаток Аффинный сорбент с лигандом.
фенилаланина в субстрате Бензилянтарная кислота изостерична
карбоксипептидазы структуре остатка фенилаланина
|
Сорбенты, содержащие цибакрон голубой и некоторые другие красители антрахинонового ряда, используют для аффинной хроматографии НАД-зависимых дегидрогеназ, а носители, имеющие цикло- пептидный антибиотик грамицидин, — для протеолитических ферментов:
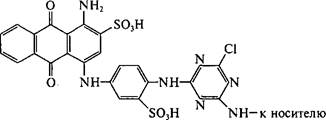 Афинный сорбент, содержащий антрахиноновый краситель
Афинный сорбент, содержащий антрахиноновый краситель
|
Таблица 4.2
Схема очистки глюкоамилазы из культуры Endomycopsis ssp. 20-9 (по И.М.Грачевой, 1987)
|
В процессе выделения повышается доля фермента в массе тотальных белков, т.е. увеличивается его удельная активность. В табл. 4.2 представлены данные, характеризующие процедуру очистки от сопутствующих ферментов и балластных белков глюкоамилазы из культуры Endomycopsis ssp. 20-9. Анализ таблицы показывает, что чистота глюкоамилазы в препарате возросла в 37 раз и в полученном препарате отсутствует активность двух ферментов углеводного обмена — гликозилтрансферазы и а-амилазы.
В производственных условиях активность получаемого ферментного препарата оценивается количеством субстрата, преобразованного 1 мг (1кг) препарата при оптимальных условиях за 1 мин, и измеряется в Е/мг, моль/мг или каталах/кг белка.
Очищенные ферментные препараты хранят при низкой температуре (до -80 °С). Для стабилизации ферментов в их препараты добавляют коферменты и субстраты. Ферментные препараты для промышленного применения стабилизируют, добавляя глицерин, моносахариды, дисахариды (глюкоза, сахароза, лактоза), HS-co- единения (цистеин, глутатион, меркаптоэтанол, дитиотреитол и др.), отдельные аминокислоты, желатину и другие белки-наполнители.
Существенно, что из 2003 включенных в список известных в настоящее время ферментов более 1500 выделено и в той или иной степени очищено; это служит не только базой для изучения физико-химических основ ферментативного катализа, но и фундаментом для совершенствования химического производства и промышленности.
4.5. ИНЖЕНЕРНАЯ ЭНЗИМОЛОГИЯ, ЕЕ ЗАДАЧИ
Развитие прикладной энзимологии долгое время сдерживалось дороговизной чистых ферментных препаратов, неустойчивостью их при хранении и невозможностью многократного использования. Принципиально новые перспективы открылись перед прикладной энзимологией в 60-е годы XX в. в результате появления на стыке химии и биологии новой отрасли — инженерной энзимологии. Ее задачи заключаются в развитии прогрессивных методов выделения ферментов, их стабилизации и иммобилизации; конструировании катализаторов с нужными свойствами и разработке научных основ их применения.
В частности, методами белковой инженерии, сущность которых состоит в изменении первичной структуры природной молекулы фермента посредством химической модификации самого; энзима или его гена, удается принципиально трансформировать структуру активного центра и его функцию, модулировать субстратную специфичность и физико-химические свойства фермента. Так, замена остатка глутамина-102 в молекуле лактатдегидро- геназы на аргинин превратила фермент в высокоактивную малат- дегидрогеназу. Описанным способом получены термостабильные формы лизоцима Т-4 и субтилизина (каталитическая константа субтилизина изменена в 100 раз), созданы гибридные формы ферментной системы, ценной в иммуноферментном анализе, сочетающие в себе свойства Р-галактозидазы и р-галактокиназы.
Многие проблемы технологии синтеза органических соединений, пищевой и медицинской промышленности, мониторинга человека и окружающей среды, защиты окружающей среды, энергетики не могут быть решены без использования методов современной инженерной энзимологии.
Важным этапом развития инженерной энзимологии стала разработка способов получения и использования иммобилизованных ферментов.
4.6. ИММОБИЛИЗОВАННЫЕ ФЕРМЕНТЫ
Иммобилизованными ферментами называются ферменты, искусственно связанные с нерастворимым носителем, но сохраняющие свои каталитические свойства.
Еще в 1916 г. Дж. Нельсон и Е.Гриффин показали, что сахароза, сорбированная на угле, сохраняла свою каталитическую активность, но лишь в 1953 г. Н. Грубхофер и Д. Шлейт впервые осуществили ковалентные связывания амилазы, пепсина, РНКазы и карбоксипептидазы с нерастворимым носителем.
В 1971 г. на первой конференции по инженерной энзимологии был узаконен термин «иммобилизованные ферменты». Однако в понятие «иммобилизация» в настоящее время вкладывают более широкий смысл, чем связывание на нерастворимом носителе, а именно — полное или частичное ограничение свободы движения белковых молекул.
Иммобилизованные ферменты имеют ряд преимуществ в сравнении со свободными молекулами. Прежде всего такие ферменты, представляя собой гетерогенные катализаторы, легко отделяются от реакционной среды, могут использоваться многократно и обеспечивают непрерывность каталитического процесса. Кроме того, иммобилизация ведет к изменению свойств фермента: субстратной специфичности, устойчивости, зависимости активности от параметров среды. Иммобилизованные ферменты долговечны и в тысячи и десятки тысяч раз стабильнее свободных энзимов. Так, происходящая при температуре 65 °С термоинактивация лак- татдегидрогеназы, иммобилизованной в 60%-м полиакриламид- ном геле, замедлена в 3600 раз по сравнению с нативным ферментом. Все перечисленное обеспечивает высокую экономичность, эффективность и конкурентоспособность технологий, использующих иммобилизованные ферменты.
4.6.1. Носители для иммобилизации ферментов
По Дж. Порату (1974), идеальные материалы, используемые для иммобилизации ферментов, должны обладать следующими основными свойствами: нерастворимостью; высокой химической и биологической стойкостью; значительной гидрофильностью; достаточной проницаемостью как для ферментов, так и для кофермен- тов, субстратов и продуктов реакции; способностью носителя легко активироваться (переходить в реакционноспособную форму).
Естественно, ни один из используемых в настоящее время в качестве носителя материал не отвечает полностью перечисленным требованиям. Тем не менее существует широкий набор носителей, пригодных для иммобилизации определенных энзимов в конкретных условиях.
В зависимости от природы носители делятся на органические и неорганические материалы.
Органические полимерные носители. Иммобилизация многих ферментов осуществляется на полимерных носителях органической природы. Существующие органические полимерные носители можно разделить на два класса: природные и синтетические полимерные носители. В свою очередь, каждый из классов органических полимерных носителей подразделяется на группы в зависимости от их строения. Среди природных полимеров выделяют белковые, полисахаридные и липидные носители, а среди синтетических — полиметиленовые, полиамидные и полиэфирные.
К преимуществам природных носителей следует отнести их доступность, полифункциональность и гидрофильность, а к недостаткам — биодеградируемость и достаточно высокую стоимость.
Из полисахаридов для иммобилизации наиболее часто используют целлюлозу, декстран, агарозу и их производные. Для придания химической устойчивости линейные цепи целлюлозы и дек- страна поперечно сшивают эпихлоргидрином. В полученные сетчатые структуры довольно легко вводят различные ионогенные группировки. Химической модификацией крахмала сшивающими агентами (формальдегид, глиоксаль, глутаровый альдегид) синтезирован новый носитель — губчатый крахмал, обладающий повышенной устойчивостью к гликозидазам.
Из природных аминосахаридов в качестве носителей для иммобилизации применяют хитин, который в значительных количествах накапливается в виде отходов в процессе промышленной переработки крабов и креветок. Хитин химически стоек и имеет хорошо выраженную пористую структуру.
Среди белков практическое применение в качестве носителей нашли структурные протеины, такие, как кератин, фиброин, коллаген и продукт переработки коллагена — желатина. Эти белки широко распространены в природе, поэтому доступны в значительных количествах, дешевы и имеют большое число функциональных групп для связывания фермента. Белки способны к биодеградации, что очень важно при конструировании иммобилизованных ферментов для медицинских целей. К недостаткам белков как носителей в этом случае следует отнести их высокую иммуно- генность.
Синтетические полимерные носители. Благодаря разнообразию и доступности материалы этой группы широко используются как носители для иммобилизации. К ним относятся полимеры на основе стирола, акриловой кислоты, поливинилового спирта; полиамидные и полиуретановые полимеры. Большинство синтетических полимерных носителей обладают механической прочностью, а при образовании обеспечивают возможность варьирования в широких пределах величины пор, введения различных функциональных групп. Некоторые синтетические полимеры могут быть произведены в различных физических формах (трубы, волокна, гранулы). Все эти свойства полезны для разных способов иммобилизации ферментов.
Носители неорганической природы. В качестве носителей наиболее часто применяют материалы из стекла, глины, керамики, графитовой сажи, силикагеля, а также силохромы, оксиды металлов. Их можно подвергать химической модификации, для чего носители покрывают пленкой оксидов алюминия, титана, гафния, циркония или обрабатывают органическими полимерами. Основное преимущество неорганических носителей — легкость регенерации. Подобно синтетическим полимерам неорганическим носителям можно придать любую форму и получать их с любой степенью пористости.
Итак, к настоящему времени создано огромное число разнообразных носителей для иммобилизации ферментов. Однако для каждого индивидуального фермента, используемого в конкретном технологическом процессе, необходимо подбирать оптимальные варианты как носителя, так и условий и способов иммобилизации.
4.6.2. Методы иммобилизации ферментов
Существуют два принципиально различных метода иммобилизации ферментов: без возникновения ковалентных связей между ферментом и носителем (физические методы иммобилизации) и с образованием ковалентной связи между ними (химические методы иммобилизации). Каждый из этих методов осуществляется разными способами (рис. 4.4).
К недостаткам адсорбционного метода следует отнести невысокую прочность связывания фермента с носителем. При изменении условий иммобилизации могут происходить десорбция фермента, его потеря и загрязнение продуктов реакции. Существенно повысить прочность связывания фермента с носителем может предварительная его модификация (обработка ионами металлов, полифункциональными агентами — полимерами, белками, гидрофобными соединениями, монослоем липида и пр.). Иногда, наоборот, модификации подвергается молекула исходного фермента, однако зачастую это ведет к снижению его активности.
Иммобилизация ферментов путем включения в гель. Способ иммобилизации ферментов путем включения в трехмерную структуру полимерного геля широко распространен благодаря своей простоте и уникальности. Метод применим для иммобилизации не только индивидуальных ферментов, но и мультиэнзимных комплексов и даже интактных клеток. Иммобилизацию ферментов в геле осуществляют двумя способами. В первом случае фермент вводят в водный раствор мономера, а затем проводят полимеризацию, в результате которой возникает пространственная структура полимерного геля с включенными в его ячейки молекулами фермента. Во втором случае фермент вносят в раствор уже готового полимера, который впоследствии переводят в гелеобразное состояние. Для первого варианта используют гели полиакриламида, поливинилового спирта, поливинилпирролидона, силикагеля, для второго — гели крахмала, агар-агара, каррагинана, агарозы, фосфата кальция.
Иммобилизация ферментов в гелях обеспечивает равномерное распределение энзима в объеме носителя. Большинство гелевых матриц обладает высокой механической, химической, тепловой и биологической стойкостью и обеспечивает возможность многократного использования фермента, включенного в его структуру. Однако метод непригоден для иммобилизации ферментов, действующих на водонерастворимые субстраты.
Иммобилизация ферментов в полупроницаемые структуры. Сущность этого способа иммобилизации заключается в отделении водного раствора фермента от водного раствора субстрата с помощью полупроницаемой мембраны, пропускающей низкомолекулярные молекулы субстратов и кофакторов, но задерживающей большие молекулы фермента. Разработано несколько модификаций этого метода, из которых интерес представляет микрокапсу- лирование и включение ферментов в липосомы.
Первый способ предложен Т.Чангом в 1964 г. и состоит в том, что водный раствор фермента включается внутрь замкнутой микрокапсулы, стенки которой образованы полупроницаемым полимером. Один из механизмов возникновения мембраны на поверхности водных микрокапсул фермента заключается в реакции межфазной поликонденсации двух соединений, одно из которых ра-] створено в водной, а другое — в органической фазе. Примером может служить образование на поверхности раздела фаз микрокапсулы, получаемой путем поликонденсации гексаметилендиа- мина-1,6 (водная фаза) и галогенангидрида себациновой кислоты (органическая фаза):
H2N-(CH2)6-NH2 + СЮС-(СН2)8-СОС1
—ны
—- -HN-(CH2)6-NH - СО—(СН2)8—СО-
Размер получаемых капсул составляет десятки или сотни микрометров, а толщина мембраны — сотые доли микрометра.
Достоинства метода микрокапсулирования — простота, универсальность, возможность многократного использования натив- ного фермента (фермент может быть отделен от непрореагировав-; шего субстрата и продуктов реакции процедурой простого фильт-, рования). Особенно существенно, что методом микрокапсулирования могут быть иммобилизованы не только индивидуальные ферменты, но и мультиэнзимные комплексы, целые клетки и отдельные фрагменты клеток. К недостаткам метода следует отнести невозможность инкапсулированных ферментов осуществлять превращения высокомолекулярных субстратов.
Близким к инкапсулированию методом иммобилизации можно считать включение водных растворов ферментов в липосомы, представляющие собой сферические или ламеллярные системы двойных липидных бислоев. Впервые данный способ был применен для иммобилизации ферментов Дж. Вайсманом и Дж. Сессом в 1970 г. Для получения липосом из растворов липида (чаще всего лецитина) упаривают органический растворитель. Оставшуюся тонкую пленку липидов диспергируют в водном растворе, содержащем фермент. В процессе диспергирования происходит самосборка бислойных липидных структур липосомы, содержащий включенный раствор фермента. }
Дата добавления: 2016-02-09; просмотров: 1881;
