Основные положения координационной теории
Строение и свойства комплексных соединений объясняются координационной теорией (швейцарский химик А. Вернер, 1893 г).
Согласно этой теории, в комплексном соединении различают внутреннюю, или координационную, и внешнюю сферы (рисунок 14).
Более прочно связанные частицы внутренней сферы образуют комплексный ион, или комплекс, который способен к самостоятельному существованию в растворе или расплаве. В формулах комплексных соединений координационная сфера заключается в квадратные скобки:

Рис. 14. Строение комплексного соединения
Внутренняя сфера состоит из центральной частицы – комплексообразователя (ион или атом) и непосредственно связанных (координированных) с ним лигандов (ионы противоположного знака или молекулы). Так, в приведенном выше примере комплексообразователем является ион меди, а лигандами – молекулы аммиака.
Число мест во внутренней сфере комплекса, которые могут быть заняты лигандами, называется координационным числом или координационной валентностью комплексообразователя.
Координационное число обычно больше степени окисления комплексообразователя, хотя встречаются комплексы и с другими соотношениями этих характеристик. Численные значения координационных чисел варьируются в пределах от 1 до 12, но наиболее часто встречающиеся (более чем у 95% комплексов) – 4 и 6.
Заряд комплексного иона определяется алгебраической суммой заряда комплексообразователя и зарядов всех лигандов, например
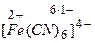 ,
, 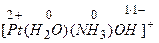 ,
, 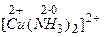
Дата добавления: 2016-02-09; просмотров: 789;
