Периодичность свойств химических элементов.
Поскольку электронная конфигурация атомов химических элементов изменяется периодически с ростом заряда их ядер, все свойства, определяемые электронным строением, закономерно изменяются по периодам и группам периодической системы. К таким свойствам относят атомные и ионные радиусы, энергию ионизации, сродство к электрону, электроотрицательность и др. В таблице 4 рассмотрены основные закономерности в изменении этих параметров в периодической системе.
Таблица 4
Закономерности изменения характеристик элементов по периоду и группе
| № п/п | параметр | определение | закономерности изменения |
| Радиус атома (с точки зрения квантовой механики атом не имеет строго определенных границ, поэтому установить его абсолютные размеры невозможно) | наиболее широко используются так называемые эффективные (т.е. проявляющие себя в действии) радиусы атомов, рассчитанные из экспериментальных данных по межъядерным расстояниям в молекулах и кристаллах. | в периодах – по мере роста заряда ядер радиусы уменьшаются; в группах – с ростом заряда ядер радиусы атомов увеличиваются. | |
| Энергия ионизации (зависит от заряда ядра, радиуса атома, конфигурации внешних электронных оболочек) | минимальная энергия, необходимая для отрыва наиболее слабого связанного электрона от невозбужденных атомов для процесса 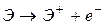
| в периодах – немонотонно возрастает; в главных подгруппах – немонотонно уменьшается. | |
| Сродство к электрону (надежные значения найдены лишь для небольшого числа элементов) | энергия процесса присоединения электрона к нейтральному атому с превращением его в отрицательный ион: 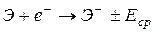
| в периодах – возрастает; в главных подгруппах – уменьшается. | |
Электроотрицательность
(ЭО или 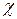 ) )
| условная величина, характеризующая способность атомов того или иного элемента в молекуле или сложном ионе смещать к себе электроны, участвующие в образовании связи. | в периодах – возрастает; в подгруппах – уменьшается. |
Химическая связь
Основное условие образования химической связи – понижение полной энергии многоатомной системы по сравнению с энергией изолированных атомов.
Природа химической связи, согласно современным представлениям, объясняется взаимодействием полей, образуемых электронами и ядрами атомов, которые участвуют в образовании химического соединения.
Химическая связь – взаимодействие атомов, обусловленное перекрыванием их электронных облаков и сопровождающееся уменьшением полной энергии системы.
В зависимости от характера распределения электронной плотности между взаимодействующими атомами различают три основных типа химической связи:
1. ковалентную;
2. ионную;
3. металлическую.
Основные параметры химической связи:
§ длина – межъядерное расстояние между химически связанными атомами; выражается в н/м;
§ кратность – это число связей между атомами в молекуле;
§ прочность – мерой прочности связи является энергия связи – это энергия, которая выделяется при образовании связи, или та энергия, которую потребуется затратить, чтобы разорвать связь между взаимодействующими атомами; выражается в кДж/моль;
§ валентный угол – угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов.
Ковалентная связь
Ковалентная связь – тип химической связи, который образуется при перекрывании электронных облаков двух связываемых атомов.
Механизмы образования ковалентной связи:
1. обменный – химическая связь образуется за счет общей пары электронов, которая образуется при перекрывании неспаренных электронов исходных атомов.
Например,  ∙+ ∙
∙+ ∙ 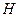 →
→ 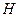 :
: 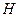
: 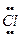 ∙ + ∙
∙ + ∙ 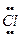 ∙→:
∙→: 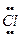 :
: 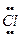 :
:
Химическая связь, образованная по обменному механизму является двухэлектронной и двухцентровой.
2. донорно-акцепторный – общая связывающая электронная пара предоставляется одним из атомов (донор электронной пары), другой атом предоставляет свободную атомную орбиталь.
Например, образование иона аммония:

H +
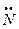 + H+ → N
+ H+ → N
H H
H H H H
Свойства ковалентной связи
1. насыщаемость – число ковалентных связей, которые способен образовать данный атом с другими атомами.
Свойство атомов того или иного элемента образовывать определенное число ковалентных связей называют валентностью.
2. направленность – одно из важнейших свойств ковалентной связи, зависящее от типа взаимодействующих электронов и числа атомов.
Ковалентная химическая связь возникает в направлении максимального перекрывания атомных орбиталей взаимодействующих атомов, которые, в свою очередь, направлены в пространстве (кроме сферических s-орбиталей), следовательно, и образуемые при этом ковалентные связи пространственно направлены.
Электронные облака имеют различную форму и ориентацию, поэтому их взаимное перекрывание реализуется различными способами.
Способы перекрывания электронных облаков:
1. 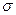 - связь– ковалентная связь, которая образуется при перекрывании электронных облаков по линии, соединяющей ядра атомов (рисунок 12).
- связь– ковалентная связь, которая образуется при перекрывании электронных облаков по линии, соединяющей ядра атомов (рисунок 12).
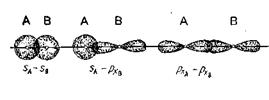
Рис. 12. Перекрывание атомных орбиталей атомов А и В при образовании s-связей
Между каждой парой атомов может быть только одна 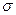 - связь.
- связь.
2. 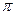 -связь – ковалентная связь, которая образуется при перекрывании электронных облаков в двух областях пространства, по обе стороны от линии, соединяющей ядра атомов (рисунок 13).
-связь – ковалентная связь, которая образуется при перекрывании электронных облаков в двух областях пространства, по обе стороны от линии, соединяющей ядра атомов (рисунок 13).
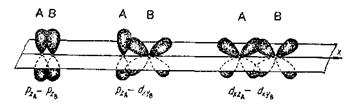
Рис. 13. Перекрывание атомных орбиталей атомов А и В при образовании p-связей
Направленность ковалентной связи обусловливает определенную пространственную конфигурацию молекул, для объяснения которой применяется представление о гибридизации атомных орбиталей.
Гибридизация – это выравнивание (усреднение) электронных орбиталей по форме и размерам, а, следовательно, и по энергии.
Гибридизация не является реальным физическим процессом. Это условный прием, позволяющий предсказать структуру молекулы при помощи комбинации атомных орбиталей.
В таблице 5 приведены данные о геометрической конфигурации молекул в зависимости от типа гибридизации центрального атома А.
3. полярность и поляризуемость связи
О степени полярности связи судят по разности значений электроотрицательности элементов, образующих соединение, по величине частичных положительных и отрицательных зарядов 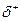 и
и 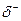 , возникающих на атомах в полярных молекулах, и по величине дипольного момента.
, возникающих на атомах в полярных молекулах, и по величине дипольного момента.
По степени полярности различают:
a) 



 неполярную ковалентную связь – образуется между атомами равных размеров и с одинаковой электроотрицательностью, при этом электронное облако расположено симметрично в пространстве между ядрами (например, Cl – Cl, N N, O O);
неполярную ковалентную связь – образуется между атомами равных размеров и с одинаковой электроотрицательностью, при этом электронное облако расположено симметрично в пространстве между ядрами (например, Cl – Cl, N N, O O);
b) полярную ковалентную связь – образуется между атомами c разной электроотрицательностью (не слишком отличающейся), при этом происходит смещение электронной плотности (общей электронной пары) к более электроотрицательному элементу (например, 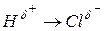 ).
).
Таблица 5
Типы гибридизации и геометрическая форма молекулы
| Число эл. пар атома А | Исходные и гибридные обритали | Тип гибридизации | Валентный угол | Геометрическая форма и состав молекулы |
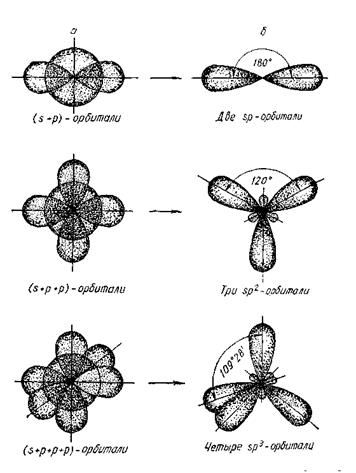
| sp | 180 °C | линейная АВ2 | |
| sp2 | 120 °C | плоский треугольник АВ3 | ||
| sp3 | 109,28 °C | тетраэдр АВ4 | ||
тригональная пирамида 
| ||||
угловая
: 
|
Дипольный момент связи  (Кл∙м) определяется по формуле:
(Кл∙м) определяется по формуле:
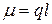 (85)
(85)
где 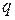 – абсолютная величина заряда, Кл;
– абсолютная величина заряда, Кл; 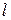 – длина диполя (вектор, направленный из центра положительного заряда к центру отрицательного заряда).
– длина диполя (вектор, направленный из центра положительного заряда к центру отрицательного заряда).
Поляризуемость связи – это способность ковалентной связи поляризоваться (деформироваться) в результате действия на молекулу внешнего электрического поля.
Поляризуемость связи зависит от заряда атомов, образующих связь, от размера атомов и формы орбиталей.
Ионная связь
Ионная связь – это химическая связь, возникающая за счет полного перехода электронов от одного атома к другому
или – это связь, энергия которой в основном определяется электростатическими силами притяжения противоположно заряженных ионов.
Характеристики ионной связи:
1. образована ионами;
2. при образовании нет общих электронных пар, нет повышенной электронной плотности в области связывания;
3. не обладает насыщаемостью;
4. не обладает направленностью.
Если представить ионы в виде несжимаемых сфер, то они располагаются в кристаллах друг около друга в порядке, позволяющем занять минимально возможный объем с минимальной потенциальной энергией.
В целом ионное соединение представляет собой большую ассоциацию ионов противоположных знаков. Поэтому химические формулы ионных соединений отражают лишь простейшее соотношение между числом атомов элементов, входящих в состав такой ассоциации.
Дата добавления: 2016-02-09; просмотров: 1352;
