Свойства переходных металлов (подгруппа железа)
(железо, кобальт, никель)
Химические свойства этих металлов достаточно схожи, поэтому рассмотрим их вместе.
1) Железо. Химический символ Fe. Расположен в VIIIb группе 4-ом периоде ПСЭ. Порядковый номер 26. Электронная конфигурация 26Fe = 1s22s22p63s23p63d64s2. Относительная атомная масса 55,85.
Кобальт. Химический символ Co. Расположен в VIIIb группе 4-ом периоде ПСЭ. Порядковый номер 27. Электронная конфигурация 27Co = 1s22s22p63s23p63d74s2. Относительная атомная масса 58,9.
Никель. Химический символ Ni. Расположен в VIIIb группе 4-ом периоде ПСЭ. Порядковый номер 28. Электронная конфигурация 28Ni = 1s22s22p63s23p63d84s2. Относительная атомная масса 58,7.
2) Плотности металлов, а также температуры плавления и кипения имеют следующие значения:
| Металл | ρ, г/см3 | Тпл ,°С | Тк, °С. |
| Fe | 7,86 | ||
| Co | 8,9 | ||
| Ni | 8,9 |
Железо обладает магнитными свойствами. При температуре 773 °С (точка Кюри) магнитные свойства исчезают. Магнитными свойствами обладают также сплавы железа и некоторые его соединения – ферриты, например Fe3O4 – магнетит, CoFe2O4 – феррит кобальта.
3) Основным методом получения Fe, Co, Ni является пирометаллургический. При этом все природные соединения переводят в оксиды, которые восстанавливают при высокой температуре коксом, СО, водородом или водяным газом (смесь СО + Н2).
Рассмотрим отдельно метод получения железа.
Вначале сульфиды железа обжигают и получают оксид железа (III)
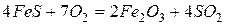
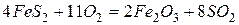
Если в качестве руды используют магнетит ( 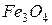 ) или гематит (
) или гематит ( 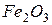 ) , то эти реакции не проводят.
) , то эти реакции не проводят.
Оксид железа (III) далее смешивают с избытком кокса и нагревают в доменных печах. Протекает реакция
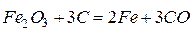
В домне восстановление протекает не сразу, а с образованием ряда промежуточных соединений, в которых понижение степени окисления железа протекает постепенно
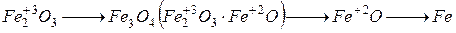
Избыток углерода растворяется в железе. При застывании расплава образуется чугун – сплав железа с содержанием углерода более 2 %. Помимо углерода, чугун содержит и другие неметаллы – P, S, N, Si. Эти примеси придают чугуну высокую хрупкость и твердость.
Следующей стадией является переплавка чугуна в сталь. Переплавку осуществляют в конвертерах. Суть метода заключается в том, что через расплав чугуна продувают кислород. При этом содержащиеся неметаллы взаимодействуют с кислородом с образованием соответствующих оксидов.
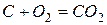
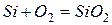
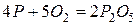
При выплавке стали в смесь добавляют специальные вещества – флюсы, которые связывают оксиды в соли, например
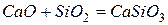
Эти соли образуют шлак, нерастворимый в металле, который собирают и удаляют. Содержание углерода в стали составляет менее 2 %. Высокоуглеродные стали содержат более 1,4 % С, низкоуглеродные – менее 1,4 % С.
Для получения высокочистых Fe, Co и Ni используют карбонильный цикл, т.к. карбонилы этих металлов легколетучи и имеют низкие температуры разложения. Например, вначале при взаимодействии железа и оксида углерода (II) образуется пентакарбонил железа 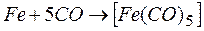 , который затем при нагревании разлагается
, который затем при нагревании разлагается 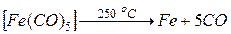 .
.
4) Fe, Co и Ni – металлы средней химической активности. 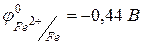 ,
, 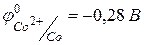 ,
, 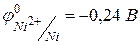 . Для железа известны степени окисления +2, +3, +6, +8, из которых наиболее устойчивы +2, +3. Для кобальта и никеля известны по две степени окисления ‑ +2, +3, при чем наиболее устойчивой является степень окисления +2. В ряду Fe‑Co‑Ni уменьшается химическая активность металлов.
. Для железа известны степени окисления +2, +3, +6, +8, из которых наиболее устойчивы +2, +3. Для кобальта и никеля известны по две степени окисления ‑ +2, +3, при чем наиболее устойчивой является степень окисления +2. В ряду Fe‑Co‑Ni уменьшается химическая активность металлов.
Эти металлы легко реагируют с галогенами, серой, кислородом, углеродом. Примеры реакций
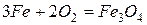
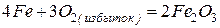
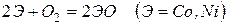
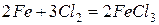
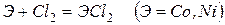
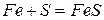
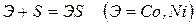
Железо с углеродом образует ряд соединений, важнейшим из которых является FeC3 – цементит, обладающий очень высокой твердостью.
Азот, фосфор, кремний способны растворяться в металлах с образованием твердых растворов.
Металлы семейства железа не взаимодействуют с водой при комнатной температуре. Однако в присутствии растворенного кислорода железо в воде подвергается коррозии.
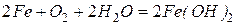 и далее
и далее
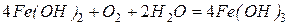
Гидроксид железа постепенно теряет воду
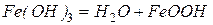 .
.
FeOOH – упрощенный состав ржавчины, который правильнее записывать как Fe2O3∙nH2O.
Все металлы относительно легко реагирует с разбавленными кислотами с образованием солей Э(II).
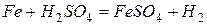
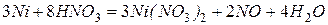
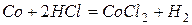
Со щелочами и их растворами при обычных условиях не взаимодействуют. При действии на Fe, Co, Ni концентрированной серной или азотной кислоты наблюдается пассивация, аналогичная для Al, Cr и ряда других металлов.
5) Железо, кобальт, никель составляют основу черной металлургии. Особо значимо использование железа, которое служит основой для производства различных сплавов, важнейшим из которых являются чугун и сталь. Из-за высокой пластичности железо не применяют в чистом виде. Для получения сплавов с заданными свойствами в железо вводят легирующие добавки – металлы, улучшающие отдельные характеристики сплавов. Так, для получения жаростойких сплавов добавляют W, твердых сталей – C, Cr, N, и т.д. Подробнее свойство сталей вы будете изучать в курсе материаловедения.
Металлы семейства железа проявляют каталитические свойства. Так никель – катализатор гидрирования, т.е. присоединения водорода. Используется для гидрирования растительных жиров в маргарин. Железо – катализатор синтеза аммиака из азота и водорода, кобальт – эффективный катализатор многих реакций, например при получении синтетического бензина из СО и Н2.
Никель используют для нанесения декоративно-защитных покрытий. Никелевые покрытия обладают высокой твердостью, красивым блеском.
Помимо металлов, широко используют и их соединения.
FeCl3 – хлорное железо, применяется в электротехнике для протравливания медных плат. При этом протекает реакция
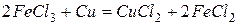
FeCl3 является катализатором многих органических реакций.
Fe2(SO4)3 применяется для осветления воды на стадиях водоподготовки. При гидролизе Fe2(SO4)3 образуется Fe(OH)3, который адсорбирует взвешенные частицы, увлекая их в осадок.
Соли кобальта и никеля применяют в производстве цветных стекол. Соединения никеля окрашивают стекло в зеленый, а кобальта ‑ в синий цвет.
Безводный СоСl2 используется как индикатор в дегидраторах – устройствах для осушки газов.
Смешанные оксиды железа (III) и некоторых металлов (Fe, Co, Ni, Mn) – ферриты – обладают магнитными свойствами. Они используются для изготовления сердечников соленоидов.
6) Железо, кобальт, никель являются микроэлементами, и в малых количествах необходимы для нормального функционирования организмов. Так, железо входит в состав гемоглобина, кобальт – в состав цитохромов и витамина В12 ‑ кобаламина. Однако в высоких концентрациях эти металлы токсичны, наибольшей токсичностью обладает никель. Высокое содержание никеля и кобальта наблюдается в почвах возле предприятий металлургической и электротехнической промышленности.
Дата добавления: 2016-02-09; просмотров: 1812;
