Внутренняя энергия.
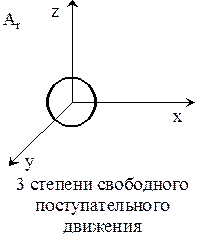
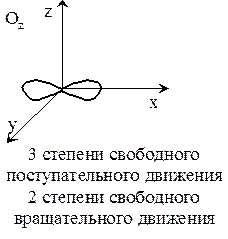
Под внутренней энергией имеется ввиду поступательное, вращательное, колебательное движение. Для реального газа каждая молекула обладает еще и постоянной энергией, зависящей от сил межмолекулярных взаимодействий.
Для идеального газа U=f(T).
Для реального газа U=j(T,P)=j’(T,V)=j”(P,V).
В технической термодинамике не интересуются абсолютным значением внутренней энергии, а только ее изменением, поэтому безразлично, какому состоянию газа приписать нулевое значение этой величины.
Энтальпия.
h=U+PV 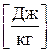 , H [Дж] – энтальпия.
, H [Дж] – энтальпия.
h=CVdT+RT=(CV+R)T=CPT.
qP=DU+PDV=U2-U1+PV2-PV1=h2-h1.
Работа расширения или сжатия.
Пусть в цилиндре под поршнем находится 1 кг газа.
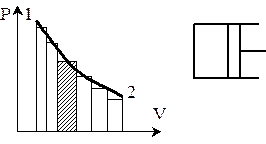
т.1. P1, V1; т.2. P2, V2; Dl=P´DV 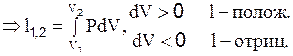
Первый закон термодинамики.
Для: 1) m кг газа Q=DU+L.
2) 1 кг газа q=DU+l.
Для ¥ малого dq=dU+dl(dq=du+dl).
dq=CVdT+PdV.
Вся подводимая теплота к рабочему телу расходуется на изменение его внутренней энергии и на совершение работы.
Энтропия.
P, V, T, u, h – параметры состояния.
Энтропия S – параметр вводимый математическим путем: 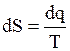 .
.
Водяной пар.
Превращение вещества из жидкого состояния в газообразное называется парообразованием. Парообразование, происходящее с любой поверхности твердого или жидкого тела называется испарением.
Испарение, происходящее как с поверхности жидкого тела, так и внутри ее называется кипением.
Пар, находящийся в термодинамическом равновесии с жидкостью, называется насыщенным. При заданной температуре ts давление насыщенного пара имеет строго определенное значение. Чем выше температура насыщения ts, тем выше давление насыщенного пара.
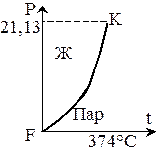
Фазовая Pt диаграмма воды.
Каждая точка кривой соответствует двухфазному состоянию. Точка K называется критической точкой. Параметры критической точки: t=374°C, P=21,13 MПа.
Точка F называется тройной точкой.
В соответствии с правилом фаз, для любой двухфазовой системы заданному давлению соответствуют одна, строго определенная температура.

Дата добавления: 2016-02-02; просмотров: 1249;
