СP и CV теплоемкости.
При P=const – изобарные CP, CP’, mCP – теплоемкости.
При V=const – изохорные CV, CV’, mCV теплоемкости.
dq=dU=PdV – первый закон термодинамики.
dqV=dU=CVdT – первый закон термодинамики для изохорного процесса.
dqr=dU+PdV=CPdT – первый закон термодинамики для изобарного процесса.
СPdT = CVdT+PdT,
CP(T2-T1) = CV(T2-T1)+P(V2-V1),
PV=RT Þ P(V2-V1) = R(T2-T1),
CP(T2-T1) = CV(T2-T1)+R(T2-T1) Þ CP=CV+R – уравнение Майера.
R>0, CP>CV, CP’>CV’, mCP>mCV.
В термодинамике большое значение имеет величина CP/CV = g = k – показатель адиабаты.
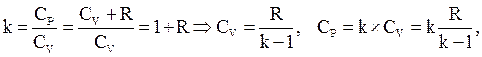
k=1,4 – для двухатомных газов.
Постоянная, переменная и средняя теплоемкости.
Теплоемкость газа зависит от физических свойств газа и, в первую очередь, от ее атомности, увеличиваясь с ростом последней. Для грубых расчетов температурную величину теплоемкости можно считать незначительной.
1. Если теплоемкость не зависит от температуры, то в системе координат C(t) площадь под прямой C(t2-t1)=q.

2. Если теплоемкость зависит от температуры, то C=a+bt+ct2+dt3.
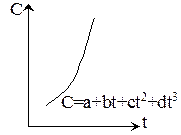
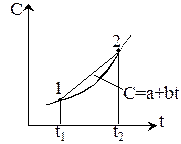
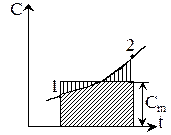
F=q=Cm(t2-t1), Cm – средняя теплоемкость для заданного температурного интервала.
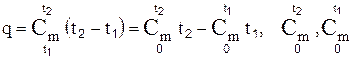 – справочные.
– справочные.
Дата добавления: 2016-02-02; просмотров: 3738;
