Первичная структура белковых молекул
Белки и нуклеиновые кислоты представляют собой информационные макромолекулы, кодирование информации в которых осуществляется соответственно аминокислотами или нуклеотидным алфавитом.
Аминокислоты соединяются друг с другом за счёт образования новой связи между атомами углерода и азота – пептидной (амидной):
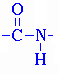
На одном конце такой цепи всегда будет группа NH2 (N-конец), а на другой - группа СООН (С-конец). Так как все аминокислотные остатки отличаются только радикалами, то белки являются квазипериодическими структурами. Четыре атомами h n c o, входящие в белковую молекулу в виде повторяющихся структур, называются пептидной (или амидной) группой.
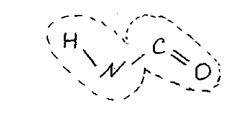
Молекулы белков и нуклеиновых кислот характеризуются строго определенной последовательностью мономеров (аминокислот и нуклеотидов), связанных ковалентными связями. Число и порядок чередования мономеров в этой последовательности называется первичной структурой.
Важная особенность структуры белков и нуклеиновых кислот заключается в стабилизации положения химических групп в пространстве с минимальной внутренней энергией. Это достигается за счет образования водородных связей. Регулярное расположение в пространстве химических групп (пептидных в белках, пуриновых оснований в нуклеиновых кислотах) создает вторичную структуру белковых молекул. Вторичная структура ДНК представляет собой двойную спираль, стабилизированную водородными связями между комплементарными азотистыми основаниями образующих спираль цепей.
Характерной особенностью пептидных трупп является их способность образовывать водородные связи друг с другом, с молекулами воды и с другими молекулами, содержащими электроотрицательные атомы О, N
Вследствие наличия простых ординарных связей каждой пептидной группы с соседними атомами углерода плоскости пептидных групп могут поворачиваться вокруг этой связи относительно друг друга.
Нахождение наиболее устойчивой конформации белковой цепи требует минимизации ее полной энергии, включая энергию внутримолекулярных водородных связей. Благодаря возможности вращения вокруг ординарных связей С-Сα и С-N пептидная связь оказывается весьма гибкой. Белок можно рассматривать как цепь из связанных друг с другом плоских пептидных звеньев.
Полинг и Кюри установили 2 основных варианта структуры белковой цепи, которые называются  -спираль и
-спираль и  -форма.
-форма.
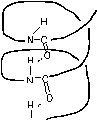
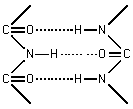
Вращение этих звеньев возможно вокруг ординарных связей α-углерода аминокислот. Вторичная структура белковой цепи имеет два основных варианта: α- спираль и β- форму. α - спирали могут быть правозакрученными и левозакрученными. β- формы могут быть параллельными и антипараллельными. α - спиральная структура устанавливается за счет продольных водородных связей в полипептидной цепи, а структура β- формы устанавливается за счет поперечных водородных связей в полипептидной цепи.
 -спираль -спираль
|  -форма -форма
|
| 
|
Рисунок - Ориентация водородных связей в структуре белка
Кроме того, в белках встречаются участки, не образующие регулярной структуры, т.н. неупорядоченные структуры. Они располагаются в местах пространственных изгибов спирализованной цепи. Упорядоченные участки часто называют кристаллической частью белковой молекулы, а неупорядоченные участки - аморфной формой белка
Возможность изгибов в цепи и наличие в молекулах белков различных взаимодействий (ионных, гидрофобных, образование водородных связей) между группами, отстоящими далеко друг от друга в полипептидной цепи, приводят к компактной укладке этой цепи. Расположение в пространстве элементов вторичной структуры и неупорядочных звеньев полипептидной цепи называется третичной структурой белка. Различие между вторичной и третичной структурами условно, т.к. в действительности мы имеем дело с единственной пространственной структурой белка.
Дата добавления: 2016-02-02; просмотров: 1381;
