Энергия активации химических реакций
Скорость химических реакций зависит от концентрации и температуры.
С увеличением температуры увеличивается число соударений, приводящих к появлению молекул нового типа. Чтобы образовать новые молекулы необходимо вначале разорвать связи между атомами и молекулами исходных веществ. На это надо затратить определенную энергию.
Поэтому предположили, что для взаимодействия молекулы должны обладать энергией не ниже некоторого уровня Е. Еакт – называется энергией активации.
Молекулы обладают потенциальной и кинетической энергией. Потенциальная энергия представляет собой энергию электронов, движущихся по орбитам. Эту энергию можно считать электронной или химической, поскольку она выделяется при химических реакциях. Кинетическая энергия – энергия теплового, хаотического движения, которая складывается из поступательного, вращательного и колебательного движения.
Для того чтобы произошла реакция, чтобы произошло образование общих электронных пар реагирующих частиц, их потенциальная энергия должна в начале возрасти, то есть реагирующие частицы должны получить энергию. Это связано с тем, что при сближении частиц их одноименно заряженные оболочки испытывают отталкивание.
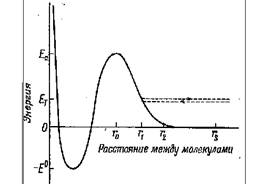
Рис. Столкновение молекул.
Сплошная кривая — потенциальная энергия молекул Аи Вв зависимости от расстояния между ними. Как видно из рисунка, их тепловая энергия ЕТ, меньше энергии активации Еа. Следовательно, реакция не происходит, так как молекулы не могут достаточно сблизиться. Пунктирная линия показывает относительное движение молекул.
Вдали друг от друга молекула Аобладает энергией, а молекула В— энергией. Общая энергия обеих с молекул равна
ЕА + ЕВ =ЕТ.
При сближении молекул между ними появляются силы отталкивания, стремятся отдалить молекулу Аот молекулы В. Когда расстояние между молекулами велико, вся энергия молекул находится в форме кинетической энергии. При сближении часть кинетической энергии превращается в потенциальную. На рисунке показан случай, когда ЕТменьше энергетического барьера Еа, и молекулы не могу даже подойти друг к другу настолько близко, чтобы произошла реакция.
Высоту пика Еаобычно называют энергией активации.
Энергия, необходимая для преодоления сил отталкивания электронных оболочек при сближении реагирующих частиц называется энергией активации.
Энергия активации представляет энергетический барьер для частиц, вступающих в реакцию. Обычно активация происходит за счет кинетической энергии.
Химическая реакция происходит только в том случае, если молекулы за счет своей кинетической энергии сумеют преодолеть энергетический барьер отталкивания электронных облаков. Не всякое столкновение приводит к химической реакции, а лишь столкновение частиц, обладающих кинетической энергией, которая не меньше энергии активации.
Дата добавления: 2016-02-02; просмотров: 1052;
