Получение инсулина.
Инсулин - гормон поджелудочной железы, регулирующий углеводный обмен и поддерживающий нормальный уровень сахара в крови. Недостаток этого гормона в организме приводит к одному из тяжелейших заболеваний - сахарному диабету, который как причина смерти стоит на третьем месте после сердечнососудистых заболеваний и рака. Инсулин - небольшой глобулярный белок, содержащий 51 аминокислотный остаток и состоящий из двух полипептидных цепей, связанных между собой двумя дисульфидными мостиками. Синтезируется он в виде одноцепочечного предшественника - препроинсулина, содержащего концевой сигнальный пептид (23 аминокислотных остатка) и 35-звенный соединительный пептид (С-пептид). При удалении сигнального пептида в клетке образуется проинсулин из 86 аминокислотных остатков, в котором А и В-цепи инсулина соединены С-пептидом, обеспечивающим им необходимую пространственную ориентацию при замыкании дисульфидных связей. После протеолитического отщепления С-пептида образуется инсулин.
Со времени открытия инсулина в 1921 году Бантингом и Бестом, которые выделили гормон из поджелудочной железы новорожденного теленка и показали снижение уровня глюкозы в сыворотке крови экспериментального животного после введения препарата, прошло больше 80 лет. За это время была создана индустрия производства инсулина.
Обычно поджелудочная железа крупного рогатого скота и свиней не используется в мясной и консервной промышленности и поставляется в вагонах-рефрижераторах на фармацевтические предприятия, где проводят экстракцию гормона. Для получения 100 г кристаллического инсулина необходимо 800 -1000 кг исходного сырья. Однако такой инсулин отличается по строению (аминокислотной последовательности) от инсулина человека и его использование напрямую малоэффективно. Например свиной инсулин отличается от человеческого на одну аминокислоту у С-конца В-цепи (аланин вместо треонина- на) Поэтому предварительно проводят химическую модификацию животного инсулина с целью придания ему структуры человеческого инсулина. Замену аланина на треонин осуществляют путем катализируемого ферментом отщепления аланина и присоединение вместо него защищенного по карбоксильной группе остатка треонина, присутствуещего в реакционной смеси в большом избытке. После отщепления защитной О-трет-бутильной группы получают инсулин человека.
Развитие с середины 1970-х годов технологии получения рекомбинантных ДНК значительно изменило характер исследований, проводимых в области генетики, молекулярной биологии и биотехнологии. Разработка методов изменения генетического аппарата клеток, позволяющих вводить в них чужеродные гены, клонировать их, экспрессировать и получать биосинтетические белки в необходимом количестве обеспечила возможность создания новой отрасли фармацевтической промышленности и обеспечения здравоохранения различными белковыми препаратами (инсулином, эритропоэтином, интерферонами и др.)
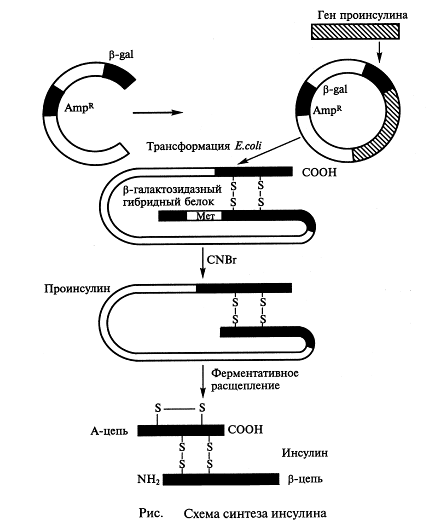
Работы по генно-инженерному получению инсулина начались около 20 лет назад. В 1978 г. появилось сообщение о получении штамма кишечной палочки, продуцирующего крысиный проинсулин (США). В этом же году были синтезированы отдельные цепи человеческого инсулина посредством экспрессии их синтетических генов в клетках Е. coli. Каждый из полученных синтетических генов последовательно подстраивался к 3 '-концу гена фермента (β-галактозидазы и вводился в векторную плазмиду (pBR322). Клетки Е. coli, трансформированные такими рекомбинантными плазмидами, производили гибридные (химерные, рекомбинантные) белки, состоящие из фрагмента β-галактозидазы, соединенной через остаток метионина с А и В цепями инсулина. При обработке in vitro химерного белка бромцианом пептид А-В высвобождался и далее ферментативно расщеплялся на фрагменты А и В. Однако замыкание дисульфидных мостиков между несвязанными С-пептидом А и В-звеньями инсулина происходило с трудом и данный метод получения инсулина не получил своего развития .
Поэтому в дальнейшем был разработан метод получения проинсулина человека целиком, с последующей его трансформацией в инсулин in vitro. Для этого искусственно была синтезирована нуклеотидная последовательность кодирующая структуру проинсулина, которая затем была встроена в плазмиду к 3 '-концу гена β-галактозидазы. Трансформированные такими плазмидами клетки Е. coli синтезировали химерный белок, состоящий из фрагментов проинсулина и β-галактозидазы, который далее in vitro последовательно превращали в инсулин человека (рис.1.).
Дата добавления: 2016-01-30; просмотров: 1569;
