Синтез L-аскорбиновой кислоты
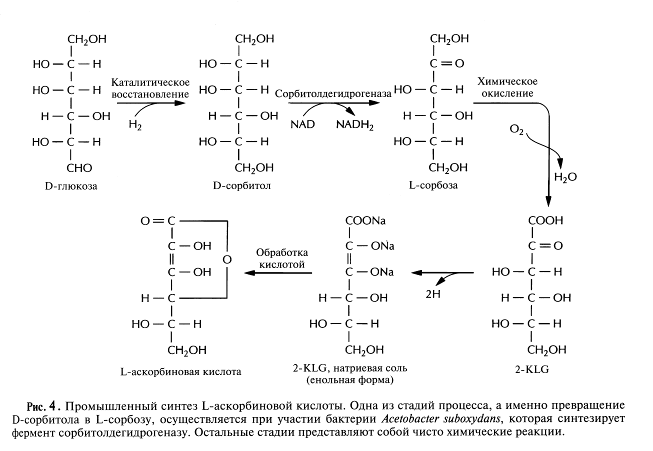
В настоящее время для крупномасштабного производства L-аскорбиновой кислоты (витамина С) используют весьма трудоемкий процесс, включающий одну микробиологическую стадию и несколько химических; исходным субстратом для него является D-глюкоза (рис.4). На последнем этапе этого процесса 2-кето-L-гулоновая кислота (2-KLG) превращается в кислых условиях в L-аскорбиновую кислоту. Биохимические исследования метаболизма различных микроорганизмов показали, что 2-KLG можно получить другим путем. Так, одни бактерии (Acetobacter, Gluconobacter и Erwinia)могут превращать глюкозу в 2,5-дикето-О-глюконовую кислоту (2,5-DKG), а другие (Corynebacterium, Brevibacteriumи Arthrobacter), синтезирующие фермент 2,5-DKG-редуктазу, - преобразовывать 2,5-DKG в 2-KLG.
Использующийся в настоящее время комбинированный способ получения аскорбиновой кислоты можно было бы существенно усовершенствовать, заменив большинство химических стадий на одну микробиологическую. Эта стадия включала бы в себя совместное культивирование указанных микроорганизмов для превращения глюкозы в 2-KLG. К сожалению, такое культивирование имеет свои трудности, поскольку эти микроорганизмы могут иметь разные оптимумы температуры и рН, могут различаться также состав среды и скорость роста. Иными словами, условия культивирования, оптимальные для одного организма, могут быть неприемлемы для другого, что приведет к спонтанному «вымыванию» из среды одного из них.
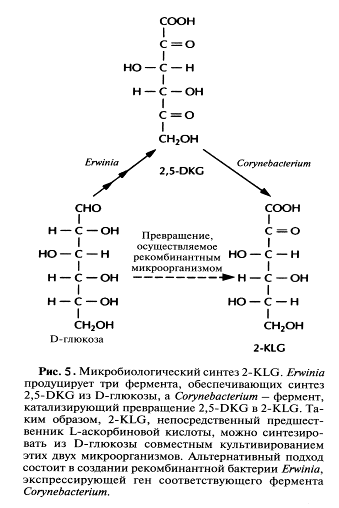
В принципе можно культивировать каждый из микроорганизмов в отдельных последовательно расположенных ферментерах, однако такой процесс трудно будет сделать непрерывным, если для роста микроорганизмов необходимы существенно разные среды. Поэтому наилучшим выходом из этой ситуации было бы создание одного микроорганизма, синтезирующего все ферменты, необходимые для превращения глюкозы в 2-KLG. Erwinia herbicolaосуществляет превращение D-глюкозы в 2,5-DKG в несколько стадий, катализируемых разными ферментами, в то время как Cotynebacterium sp. для превращения 2,5-DKG в 2-KLG необходима только одна стадия. Следовательно, наиболее простой способ создания одного микроорганизма, способного превращать D-глюкозу в 2-KLG, состоит в выделении гена 2,5-ОКС-редуктазы Corynebacterium sp. и введении его в Erwinia herbicola
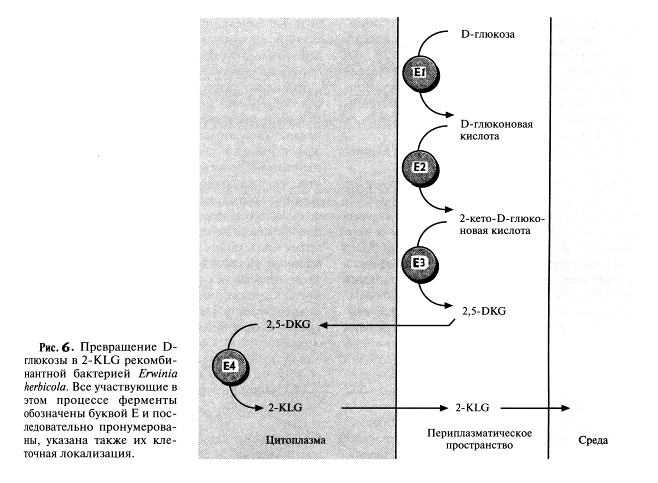
После получения такие трансформированные клетки Erwiniaактивно превращали D-глюкозу непосредственно в 2-KLG, при этом собственные ферменты Erwinia,локализованные во внутренней мембране бактериальной клетки, преобразовывали глюкозу в 2,5-DKG, а 2,5-DKG-редуктаза, локализованная в цитоплазме, катализировала превращение 2,5-DKG в 2-KLG (рис.6). Таким образом, с помощью генетических манипуляций метаболические реакции, протекающие в столь разных микроорганизмах, удалось осуществить в одном из них. Этот гибрид приобрел способность синтезировать конечный продукт комбинированного метаболического пути. Такой организм можно использовать как фабрику для производства 2-KLG, заменяющую первые три стадии в том процессе получения L-аскорбиновой кислоты, который используют в настоящее время.
Антибиотики
Со времени открытия пенициллина в конце 1920-х годов из различных микроорганизмов были выделены тысячи антибиотиков, обладающих разной специфичностью и разным механизмом действия. Их широкое применение для лечения инфекционных заболеваний помогло сохранить миллионы жизней. Подавляющее большинство основных антибиотиков было выделено из грамположительной почвенной бактерии Streptomyces,хотя их продуцируют также грибы и другие грамположительные и грамотрицательные бактерии.
В настоящее время в рамках обширных исследовательских программ по скринингу природных микробных сообществ каждый год ученые обнаруживают от 100 до 200 новых антибиотиков, многие из которых имеют уникальные структуры и характеристики. Однако получение и клинические испытания новых препаратов обходятся очень дорого и занимают много времени. Поэтому в продажу поступают не более 1-2% всех обнаруживаемых этим путем антибиотиков. Большой эффект здесь может дать технология рекомбинантных ДНК. Во-первых, с ее помощью можно создавать новые антибиотики с уникальной структурой, оказывающие более мощное воздействие на определенные микроорганизмы и обладающие минимальными побочными эффектами. Во-вторых, генноинженерные подходы могут использоваться для увеличения выхода уже известных антибиотиков и соответственно для снижения стоимости их производства.
Однако на пути использования генно-инженерных технологий имеется целый ряд препятствий. Это связано с тем, что синтез молекул антибиотиков является сложным многостадийным процессом, включающим в себя различные типы химических реакций и требующим большого числа ферментов различных классов. Общее число генов, задействованных для их синтеза, может достигать до 1-2 и более % от общего числа генов, и они могут иметь различную локализацию в хромосомах. Все это существенно затрудняет анализ путей биосинтеза антибиотиков и идентификацию отдельных мутаций, способных увеличить выход продукта. Поэтому, пока, большинство известных в настоящее время высокопродуктивных штаммов продуцентов антибиотиков получено традиционными методами мутагенеза и селекции.
Дата добавления: 2016-01-30; просмотров: 1162;
