Азотистая и азотная кислоты и их соли
Азотистая кислота существует либо в растворе, либо в газовой фазе. Она неустойчива и при нагревании распадается в парах:
2HNO2 «NO+NO2+Н2О
Водные растворы этой кислоты при нагревании разлагаются:
3HNO2«HNO3+H2O+2NO
Эта реакция обратимая, поэтому, хотя растворение NO2 и сопровождается образованием двух кислот: 2NO2 + Н2O=HNO2+HNO3
практически взаимодействием NO2 с водой получают HNO3:
3NO2+H2O=2HNO3+NO
По кислотным свойствам азотистая кислота лишь немного сильнее уксусной. Соли ее называются нитритами и в отличие от самой кислоты являются устойчивыми. Из растворов ее солей можно добавлением серной кислоты получить раствор HNO2:
Ba(NO2)2+H2SO4=2HNO2+BaSO4¯
На основе данных о ее соединениях предполагают два типа структуры азотистой кислоты:
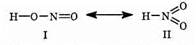
которым соответствуют нитриты и нитросоединения. Нитриты активных металлов имеют структуру I типа, а малоактивных металлов — II типа. Почти все соли этой кислоты хорошо растворимы, но нитрит серебра труднее всех. Все соли азотистой кислоты ядовиты. Для химической технологии важны KNO2 и NaNO2, которые необходимы для производства органических красителей. Обе соли получают из оксидов азота:
NO+NO2+NaOH=2NaNO2+Н2О или при нагревании их нитратов:
KNO3+Pb=KNO2+PbO
Pb необходим для связывания выделяющегося кислорода.
Из химических свойств HNO2 сильнее выражены окислительные, при этом сама она восстанавливается до NO:
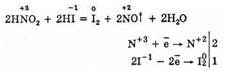
Однако можно привести много примеров таких реакций, где азотистая кислота проявляет восстановительные свойства:
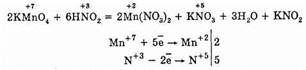
Определить присутствие азотистой кислоты и ее солей в растворе можно, если прибавить раствор иодида калия и крахмала. Нитрит-ион окисляет анион иода. Эта реакция требует присутствия Н+, т.е. протекает в кислой среде.
Азотная кислота
В лабораторных условиях азотную кислоту можно получить действием концентрированной серной кислоты на нитраты:
NaNO3+H2SO4(к)=NaHSO4+HNO3 Реакция протекает при слабом нагревании.
Получение азотной кислоты в промышленных масштабах осуществляется каталитическим окислением аммиака кислородом воздуха:
1. Вначале смесь аммиака с воздухом пропускают над платиновым катализатором при 800°С. Аммиак окисляется до оксида азота (II):
4NH3 + 5O2=4NO+6Н2О
2 . При охлаждении происходит дальнейшее окисление NO до NO2: 2NO+O2=2NO2
3. Образующийся оксид азота (IV) растворяется в воде в присутствии избытка О2 с образованием HNO3: 4NO2+2Н2O+O2=4HNO3
Исходные продукты — аммиак и воздух — тщательно очищают от вредных примесей, отравляющих катализатор (сероводород, пыль, масла и т.п.).
Образующаяся кислота является разбавленной (40-60% -ной). Концентрированную азотную кислоту (96-98% -ную) получают перегонкой разбавленной кислоты в смеси с концентрированной серной кислотой. При этом испаряется только азотная кислота.
Физические свойства
Азотная кислота — бесцветная жидкость, с едким запахом. Очень гигроскопична, «дымит» на воздухе, т.к. ее пары с влагой воздуха образуют капли тумана. Смешивается с водой в любых соотношениях. При -41,6°С переходит в кристаллическое состояние. Кипит при 82,6°С.
В HNO3 валентность азота равна 4, степень окисления +5. Структурную формулу азотной кислоты изображают так:
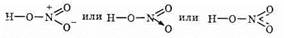
Оба атома кислорода, связанные только с азотом, равноценны: они находятся на одинаковом расстоянии от атома азота и несут каждый по половинному заряду электрона, т.е. четвертая часть азота разделена поровну между двумя атомами кислорода.
Электронную структуру азотной кислоты можно вывести так:
1. Атом водорода связывается с атомом кислорода ковалентной связью:
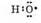
2. За счет неспаренного электрона атом кислорода образует ковалентную связь с атомом азота:
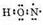
3. Два неспаренных электрона атома азота образуют ковалентную связь со вторым атомом кислорода:
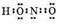
4. Третий атом кислорода, возбуждаясь, образует свободную 2р-орбиталь путем спаривания электронов. Взаимодействие неподеленной пары азота со свободной орбиталью третьего атома кислорода приводит к образованию молекулы азотной кислоты:
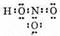
Химические свойства
1. Разбавленная азотная кислота проявляет все свойства кислот. Она относится к сильным кислотам. В водных растворах диссоциирует:
HNO3«Н++NO-3 Под действием теплоты и на свету частично разлагается:
4HNO3=4NO2+2Н2O+O2 Поэтому хранят ее в прохладном и темном месте.
2. Для азотной кислоты характерны исключительно окислительные свойства. Важнейшим химическим свойством является взаимодействие почти со всеми металлами. Водород при этом никогда не выделяется. Восстановление азотной кислоты зависит от ее концентрации и природы восстановителя. Степень окисления азота в продуктах восстановления находится в интервале от +4 до -3:
HN+5O3 ®N+4O2®HN+3O2 ®N+2O®N+12O®N02®N-3H4NO3
Продукты восстановления при взаимодействии азотной кислоты разной концентрации с металлами разной активности приведены ниже в схеме.
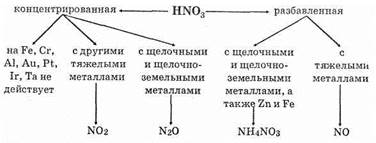
Концентрированная азотная кислота при обычной температуре не взаимодействует с алюминием, хромом, железом. Она переводит их в пассивное состояние. На поверхности образуется пленка оксидов, которая непроницаема для концентрированной кислоты.
Примеры:
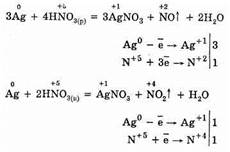
3. Азотная кислота не реагирует с Pt, Rh, Ir, Та, Au. Платина и золото растворяются в «царской водке» — смеси 3 объемов концентрированной соляной кислоты и 1 объема концентрированной азотной кислоты:
Au+НNO3+3НСl= AuСl3+NO+2Н2О НСl+AuСl3=H[AuCl4]
3Pt+4HNO3+12НСl=3PtCl4+4NO+8H2O 2HCl+PtCl4=H2[PtCl6]
Действие «царской водки» заключается в том, что азотная кислота окисляет соляную до свободного хлора:
HNO3+HCl=Сl2+2Н2О+NOCl 2NOCl=2NO+Сl2 Выделяющийся хлор соединяется с металлами.
4. Неметаллы окисляются азотной кислотой до соответствующих кислот, а она в зависимости от концентрации восстанавливается до NO или NO2:
S+бНNO3(конц)=H2SO4+6NO2+2Н2ОР+5НNO3(конц)=Н3РO4+5NO2+Н2О I2+10HNO3(конц)=2HIO3+10NO2+4Н2О 3Р+5HNO3(pазб)+2Н2О= 3Н3РО4+5NO
5. Она также взаимодействует с органическими соединениями.
Соли азотной кислоты называются нитратами, представляют собой кристаллические вещества, хорошо растворимые в воде. Их получают при действии HNO3 на металлы, их оксиды и гидроксиды. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры используются главным образом как минеральные азотные удобрения. Кроме того, KNO3 применяют для приготовления черного пороха (смесь 75% KNO3, 15% С и 10% S). Из NH4NO3, порошка алюминия и тринитротолуола изготавливают взрывчатое вещество аммонал.
Соли азотной кислоты при нагревании разлагаются, причем продукты разложения зависят от положения солеобразующего металла в ряду стандартных электродных потенциалов:
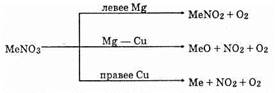
Разложение при нагревании (термолиз) — важное свойство солей азотной кислоты.
2KNO3=2KNO2+O2
2Cu(NO3)2=2CuO+NO2+O2
Соли металлов, расположенных в ряду левее Mg, образуют нитриты и кислород, от Mg до Cu — оксид металла, NO2 и кислород, после Си — свободный металл, NO2 и кислород.
Применение
Азотная кислота — важнейший продукт химической промышленности. Большие количества расходуются на приготовление азотных удобрений, взрывчатых веществ, красителей, пластмасс, искусственных волокон и др. материалов. Дымящая
азотная кислота применяется в ракетной технике в качестве окислителя ракетного топлива.
Дата добавления: 2016-01-03; просмотров: 18299;
