Производство аминокислот
Среди соединений, получаемых биотехнологическими методами, аминокислоты занимают первое место по объему производства и второе место по стоимости, уступая по последнему параметру лишь антибиотикам. Объем мирового производства аминокислот составляет более 500 тыс. т в год, из которых 300 тыс. т приходится наглутамат натрия, 100 тыс. т на лизин и 140 тыс. т на метионин. Однако указанный объем — лишь небольшая доля от требуемого количества аминокислот. По данным ВОЗ, потребность человечества всего лишь в четырех незаменимых аминокислотах составляет, млн т: для лизина - 5, метио-нина - 4, треонина - 3,7 и триптофана - 2.
Аминокислоты — структурные единицы белков. Природные аминокислоты вовлечены в биосинтез ферментов, ряда гормонов, витаминов, антибиотиков, алкалоидов, токсинов и других азотсодержащих соединений (пурины, пиримидины, гем и пр.). В организме животного практически половина белковых аминокислот не синтезируется. Они называются незаменимыми аминокислота-мии должны поступать в организм с пищей. Недостаток каждой из этих амино-кислот в пищевом или кормовом рационе приводит к нарушению обмена веществ, замедлению роста и развития.
Пищевая ценность белка определяется сравнением доли незаменимых аминокислот в пище с этим же показателем при адекватном питании. Чем ближе обе величины, тем выше качество белка. Белки яйца и молока обладают высокой пищевой ценностью и используются в качестве эталона при оценке других белков. Многие белки растительного происхождения характеризуются дефицитом некоторых незаменимых аминокислот. Так, белки пшеницы и риса обеднены лизином и треонином, а белки кукурузы - лизином и триптофаном. Введение синтетических незаменимых аминокислот в кормовые концентраты позволяет балансировать корма сельскохозяйственных животных по уровню белка. При добавлении 2-4 дефицитных аминокислот к 1 т комбикорма общий расход кормов уменьшается на 15 - 20 %, выход продукции увеличивается на 20 %. Добавление к кормам аминокислот способствует переводу животноводства на промышленную основу.
Помимо применения в качестве пищевых добавок, приправ и усилителей вкуса аминокислоты используют как сырье в химической, парфюмерной и фармацевтической промышленности и при производстве ряда других веществ:
глицин - подсластитель, антиоксидант, бактериостатик;
1.аспарагиновая кислота - усилитель вкуса, сырье для синтеза аспартама;
2.глутаминовая кислота - усилитель вкуса, препарат для лечения психических заболеваний;
3.гистидин - противовоспалительное средство;
4.метионин - пищевая и кормовая добавки;
5.цистеин - фармацевтический препарат;
6.треонин и триптофан - пищевые и кормовые добавки;
7.фенилаланин - сырье для получения аспартама;
8.лизин - пищевая и кормовая добавки, сырье для получения искусственных волокон и пленок.
В промышленных масштабах белковые аминокислоты получают:
1) гидролизом природного белоксодержащего сырья;
2) химическим синтезом;
3) микробиологическим синтезом;
4) биотрансформацией предшественников аминокислот с помощью микроорга-низмов или выделенных из них ферментов (химико-микробиологический метод).
При гидролизебелоксодержащее сырье (отходы пищевой и молочной промышленности) нагревают с растворами кислот или щелочей при температуре 100 — 105 °С в течение 20 — 48 ч. Чаще всего используют 20 %-й раствор соляной кислоты, обеспечивающий глубокий гидролиз белка. Кроме того, для ускорения реакции гидролиза белков используют иммобилизованные протеолитические ферменты и ионообменные смолы. В ходе кислотного гидролиза белков происходят рацемизация и разрушение некоторых составляющих их аминокислот. При кислотном гидролизе полностью разрушается триптофан и достаточно значительны потери цистеина, метионина и тирозина (10-30%). Лучшим способом уменьшения потерь аминокислот при гидролизе является проведение его в вакууме или в атмосфере инертного газа, а также соблюдение высокого соотношения количества кислоты, взятой для гидролиза, и массы белка (200:1). Рациональное использование сырья при гидролизе, характерное для многих других биотехнологических производств, обеспечивает создание безотходных технологий и способствует оздоровлению окружающей среды. Ранее методом гидролиза получали аминокислоты исключительно для фармацевтических и научных целей. В последнее время сфера использования белковых гидролизатов существенно расширилась. Их применяют в медицине, животноводстве, пищевой и микробиологической промышленности.
Существенный недостаток методов химического синтезааминокислот состоит в получении целевых препаратов в виде рацемической смеси D- и L-стереоизомерных форм. Подавляющее большинство природных аминокислот относится к L-ряду. D-aминокислоты обнаружены лишь в составе гликопротеинов клеточных стенок бактерий, антибиотиков и некоторых токсинов. Проницаемость L-аминокислот в клетке в 500 раз превышает таковую ее антипода. Стереоспецифичны также транспорт и метаболизм аминокислот. Исключением в этом отношении является лишь метионин, метаболизм которого нестереоизбирателен, благодаря чему данная аминокислота получается преимущественно путем химического синтеза. Разделение рацематов других аминокислот - дорогая и чрезвычайно трудоемкая процедура.
Наиболее перспективен и экономически выгоден микробиологическийсинтез аминокислот. Более 60 % всех производимых в настоящее время промышленностью высокоочищенных препаратов белковых аминокислот получают именно этим способом, главное преимущество которого в сравнении с методами химического синтеза состоит в возможности получения L-аминокислот на основе возобновляемого сырья.
В последние годы при производстве аминокислот все шире используют биотрансформацию предшественников аминокислот, особенно с помощью иммобилизованных ферментов или клеток микроорганизмов, предварительно получаемых химическим путем.
Промышленное производство аминокислот микробиологическим способом стало возможным после открытия способности у некоторых микроорганизмов выделять в культуральную среду определенные количества какой-либо одной аминокислоты (С. Киносита, 1955). При этом было подмечено, что большинство из нескольких тысяч проанализированных диких штаммов микроорганизмов если и продуцировали аминокислоты во внешнюю среду, то в очень незначительных количествах. Это не удивительно, поскольку аминокислоты являются важнейшими промежуточными метаболитами в синтезе белков, а в избыточных количествах токсичны для продуцирующих клеток. Поэтому их синтез в клетках бактерий подчиняется принципу жесткой экономии внутриклеточных ресурсов и оптимизирован в процессе эволюции. Избыточное накопление аминокислот в клетках возможно только в условиях нарушения нормального метаболизма, т.е. нахождения клеток продуцента в состоянии идиофазы. Поэтому, формально являясь первичными метаболитами, промышленно получаемые аминокислоты фактически являются вторичными метаболитами. Не зафиксировано никакой связи между таксономическим положением микроорганизма и способностью к продуцированию той или иной аминокислоты. Так, среди возможных продуцентов глутаминовой кислоты отмечены организмы, из которых 30 % - дрожжи, 30 % - стрептомицеты, 20 % - бактерии и 10 % - микроскопические грибы. И лишь один из обследованных штаммов микроорганизмов — Corynebacterium glutamicumобладал способностью к сверхсинтезу глутамата. Этот штамм использовали при организации первого в мире крупномасштабного производства глутаминовой кислоты микробиологическим методом в Японии (1956). В России изыскания в области промышленного синтеза аминокислот были начаты в 50-х годах прошлого столетия по инициативе акад. А. А. Александрова.
Перспективные штаммы продуцентов постоянно улучшают посредством селекции мутантов с измененной генетической программой и регуляторными свойствами. Для получения мутантных штаммов используют как традиционные методы селекции и мутагенеза, так и методы генной инженерии. Распространенные объекты селекции продуцентов — микроорганизмы, относящиеся к родам Brevibacterium, Micrococcus, Corynebacterium, Arthrobacter.
Разработка технологической схемы получения той или иной отдельной аминокислоты должно базироваться на максимально точном знании путей и механизмов регуляции ее биосинтеза. Необходимого дисбаланса метаболизма, обеспечивающего сверхсинтез целевого продукта, добиваются путем строго контролируемых изменений состава среды и условий культивирования.
Производство лизина.По содержанию лизина наименее сбалансированы белки злаковых культур, у которых его дефицит составляет от 20 до 50 %. На территории России недостаток лизина в кормах не может быть восполнен за счет сои, поэтому в нашей стране производство этой аминокислоты было организовано первым. Для удовлетворения потребностей животноводства в лизине крупнотоннажное производство налажено в Испании, Франции, Японии и США.
В клетках микроорганизмов лизин синтезируется из аспарагиновой кислоты и служит конечным продуктом разветвленного метаболического пути биосинтеза, общего для трех аминокислот - лизина, метионина и треонина. При этом образование лизина и треонина в клетке бактерии находится под строгим метаболическим контролем. У типичных продуцентов L-лизина — Brevibacterium flavum и Corynebacterium glutamicum - фермент аспартаткиназа, открывающий метаболический путь, является уникальным аллостерическим белком, чувствительным к ингибированию по принципу обратной связи при одновременном связывании аллостерического центра с молекулами L-треонина и L-лизина. При одновременном накоплении треонина и лизина в избыточной концентрации аспартаткиназа ингибируется и их синтез останавливается, при понижении концентрации любой из двух аминокислот процесс активизируется.
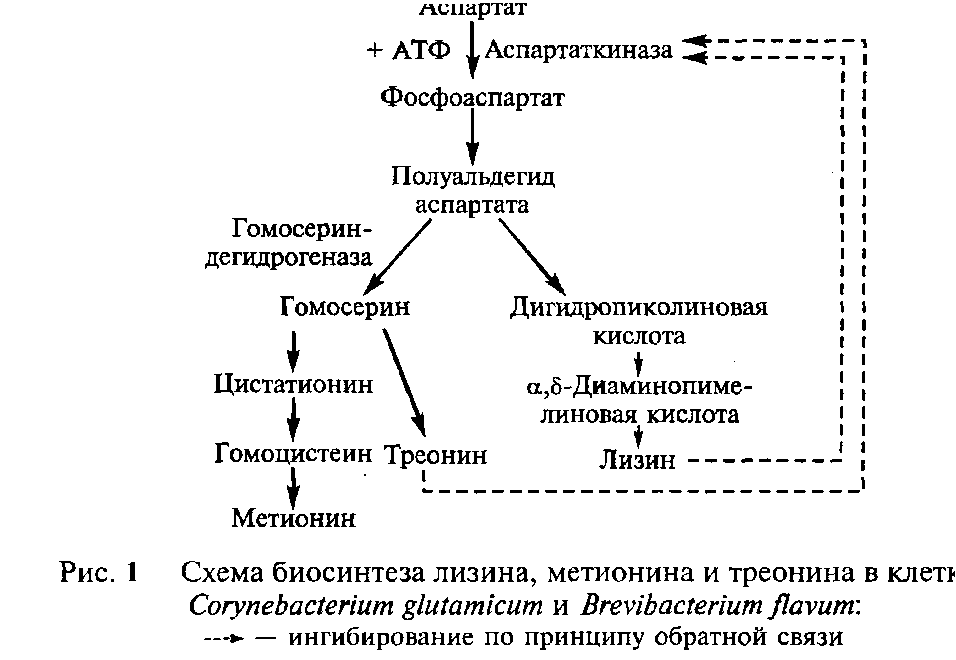
Для того, чтобы добиться избыточного накопления в клетке целевой аминокислоты (лизина) используют два основных подхода.
Первый подход основан на использовании мутантных штаммов, у которых не синтезируется или не функционирует фермент - гомосериндегидрогеназа, в результате у них блокирован синтез треонина и метионина, т.е. одной из аминокислот ингибирующей совместно с лизином аспартаткиназу. Поскольку обойтись без этих двух аминокислот клетки не могут, то такие мутанты являются ауксотрофами по треонину и метионину, т.е. для их нормального выращивания необходимо добавлять готовый метионин и треонин в питательную среду. Если добавлять эти аминокислоты в небольших (лимитирующих) количествах, достаточных только для восполнения минимальных потребностей клеток, то внутриклеточная концентрация треонина будет у них существенно ниже той, что вызывает блокаду с аспартаткиназы. Поэтому при любых высоких концентрациях лизина в клетке ингибирования аспартаткиназы не будет. Таким образом, можно добиться сверхсинтеза лизина в количествах многократно превышающих потребности клеток-продуцентов..
Второй подход основан на использовании мутантных штаммов у которых имются дефекты в структурном гене, определяющем конформацию аспартаткиназы. Такой фермент теряет чувствительность к высоким концентрациям своего аллостерического ингибитора — лизина и эффект ретроингибирования не проявляется.
Как уже отмечалось, в избыточных количествах аминокислоты токсичны для продуцирующих их клеток. Поэтому, важным фактором, обеспечивающим их максимальный сверхсинтез, является создание условий для максимально возможного и быстрого их выведения (секреции) из клеток в культуральную среду, а так же и из самой культуральной среды. Увеличение секреции достигается обычно увеличением проницаемости клеточных мембран. Практически, проницаемость клеточной мембраны увеличивают либо с помощью мутаций, либо путем изменения состава питательной среды. В последнем случае в культуральной среде создают дефицит биотина (1 — 5 мкл/л), добавляют пенициллин (2 - 4 мкг/л), детергенты (твин-40 и твин-60) или производные высших жирных кислот (пальмитаты, стеараты). Биотин контролирует содержание в клеточной мембране фосфолипидов, а пенициллин нарушает биосинтез клеточных стенок бактерий, что повышает выделение аминокислот в среду. Удаление аминокислот из культуральной жидкости в процессе культивирования (без остановки процесса) достигается ее отбором и пропусканием через колонку с соответствующими сорбентами, обычно ионообменными смолами. Иногда в среду для культивирования добавляют нетоксичные вещества, которые взаимодействуют с молекулами аминокислот и переводят их в нерастворимое состояние (в осадок). Часто проводят и процедуру коррекции величины рН среды, поскольку накопление больших количеств аминокислоты может сильно отклонить ее от оптимального значения.
Для культивирования штаммов микроорганизмов при производстве аминокислот как источники углерода наиболее доступны углеводы - глюкоза, сахароза и реже фруктоза и мальтоза. Для снижения стоимости питательной среды в качестве источников углерода используют вторичное сырье: свекловичную мелассу (маточный раствор после выделения кристаллов сахара в процессе упаривания сахарсодержащих жидкостей), молочную сыворотку, гидролизаты крахмала, сульфитные щелока. Технология этого процесса совершенствуется в направлении разработки дешевых синтетических питательных сред на основе уксусной кислоты (до 1,5%), пропионовой кислоты, метанола, этанола (до 1 %) и н-парафинов. В качестве источников азота применяют мочевину и соли аммония (сульфаты и фосфаты). Для успешного развития микроорганизмы нуждаются в стимуляторах роста, в качестве которых выступают экстракты кукурузы, дрожжей и солодовых ростков, гидролизаты отрубей и дрожжей, витамины группы В. Кроме того, в питательную среду добавляют необходимые для жизнедеятельности макро- и микроэлементы (Р, Са, Mg, Mn, Fe и др.). На процесс биосинтеза аминокислот существенное влияние оказывает снабжение воздухом, при этом степень аэрации индивидуальна для производства каждой конкретной аминокислоты.
Опыты показали, что лизин появляется в культуральной среде начиная с середины экспоненциальной фазы роста культуры клеток микроорганизма и достигает максимума к ее концу. Поэтому на первой стадии технологического процесса формируют биомассу продуцента, которую выращивают в специальных посевных аппаратах в течение суток (рН 7,0-7,2; температура 28 - 30 °С), а затем подают в производственный ферментер, заполненный питательной средой. Лизин начинает поступать в культуральную жидкость через 25-30 ч после начала ферментации. По завершении процесса ферментации (через 55 - 72 ч) жидкую фазу отделяют от культуры клеток микроорганизма фильтрованием и используют для выделения из нее лизина.
Высокоочищенные препараты лизина получают после фракционирования фильтрата культуральной жидкости методом ионообменной хроматографии на катионите.
Производство триптофана.Триптофан достаточно часто является лимитирующим фактором питания, так как его содержание в традиционных продуктах (рыба, молоко, кормовые дрожжи) в 3 раза ниже, чем в стандартном белке.
Подобно лизину триптофан образуется в ходе разветвленного метаболического пути, поэтому для его производства используют ауксотрофных мутантов, у которых блокированы реакции, ведущие к синтезу фенилаланина и тирозина. Однако при выращивании мутантных штаммов в среде с минимальной концентрацией этих аминокислот, не вызывающей регуляторных эффектов, избыточное накопление триптофана в среде все равно не наблюдается, что объясняется особенностью процессов регуляции биосинтеза триптофана у микроорганизмов.
Наряду с другими ароматическими аминокислотами у микроорганизмов и растений триптофан образуется из метаболитов углеводного обмена - эритрозо-4-фосфата и фосфоенолпирувата.
Процесс новообразования ароматических аминокислот идет через шикимовую и хоризмовую кислоты. Метаболическим предшественником триптофана служит антраниловая кислота, которая возникает из хоризмовой кислоты под действием антранилат-синтетазы. Образующийся триптофан оказывает ингибирующее действие на антранилатсинтетазу, поэтому для обхода метаболического контроля синтез этого фермента индуцируют ступенчатым введением предшественника - антраниловой кислоты (0,1—0,3 %), которая достаточно легко может быть получена методом химического синтеза:
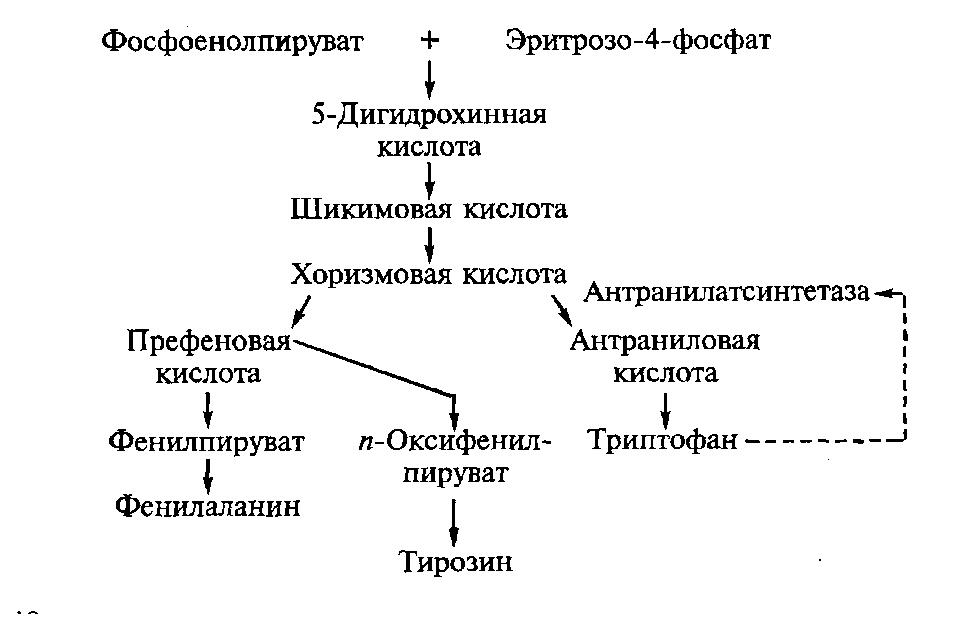
В связи с этой особенностью промышленное производство триптофана организовано преимущественно по двухступенчатой схеме. На первом этапе химическим способом синтезируют антраниловую кислоту, которую с помощью энзиматической системы мутантных штаммов дрожжей Candida utilisпереводят в триптофан.
Биомассу дрожжей выращивают при температуре 30 °С в среде, содер-жащей свекловичную мелассу, мочевину и минеральные компоненты. Через сутки в ферментер вводят 5 %-й спиртовой раствор антраниловой кислоты и 50 %-й раствор мочевины, а через 3 -4 ч после введения предшественника дополнительно добавляют источник углерода (25 %-й раствор мелассы). Антраниловую кислоту и мочевину подают через каждые 6 ч, а мелассу - через каждые 12 ч. Процесс двухступенчатой ферментации завершается через 144 ч и обеспечивает содержание триптофана в культуральной среде до 6 г/л.
Кроме триптофана микробиологическим способом с использованием предшественников получают гистидин, изолейцин, метионин, серии и треонин.
Менее распространены одноступенчатые технологии получения триптофана на основе ауксотрофных мутантов бактерии Bacillus subtilis, осуществляемые по схеме, близкой к способу получения лизина. Длительность одноступенчатого процесса 48 ч, а концентрация триптофана в культуральной среде составляет 10 г/л.
После сушки культуральной жидкости получают кормовой концентрат триптофана (ККТ), который включает белки, свободный триптофан, витамины Вь В2 и PP. Высокоочищенные кристаллические препараты триптофана образуются после дополнительной очистки культуральной жидкости методом ионообменной хроматографии на колонке, заполненной катионитом (сорбция при рН 1,0; элюция 5%-м раствором гидроксида аммония в смеси с пропанолом-2). Элюаты кристаллизуют; кристаллы отмывают и высушивают. Кристаллический препарат содержит до 99 % триптофана.
Характерная особенность процессов получения аминокислот микробиоло-гическим способом, равно как и других биотехнологических производств, - полное использование побочных продуктов, что превращает большинство из них в безотходные и экологически чистые технологии. Например, осадок микроорга-низмов-продуцентов и промывные воды, содержащие ценные ингредиенты, такие, как белки, остатки аминокислот, витаминов, минеральных солей и микроэлементов, высушивают и используют в качестве кормовых препаратов.
В последние годы при производстве аминокислот все шире используют комбинированный способ, включающий биотрансформацию предшественников аминокислот, предварительно получаемых химическим путем.
При получении ряда аминокислот химико-ферментативными способами используют ферменты, принадлежащие к разным классам. Эти процессы могут быть как одностадийными (конверсии), так и многостадийными. Источником ферментов для большинства процессов служат различные микроорганизмы. При этом могут использоваться как чистые ферментные препараты, так и клетки в различном состоянии: интактные (нерастущие), поврежденные, высушенные, замороженные, иммобилизованные и т.д.
Применение ферментов в производстве аминокислот обеспечивает стереоспецифичность процессов их синтеза, что выгодно отличает биотехнологические производства от химических.
Получение L-лизина.Процесс получения L-лизина основан на стереоспецифическом ферментативном гидролизе (конверсии) D-,L-α-амино-ε-капролактама, который сначала получают химическим путем из циклогексена.
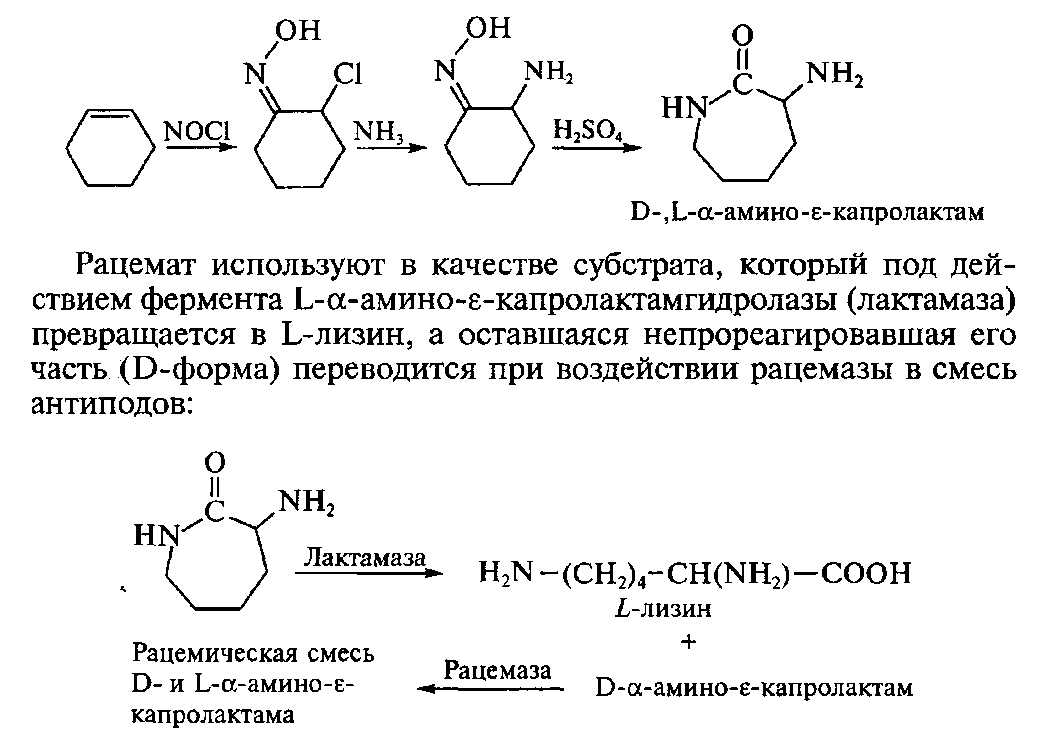
При производстве лизина в водный раствор D-,L-α-амино-ε-капролактама одновременно вводят либо оба фермента, либо проводят процесс в присутствии обоих продуцентов. Процесс осуществляют при температуре 30-500С, рН 8,0-8,5 и оптимальном режиме аэрации. По окончании процесса содержание лизина в реакционной среде превышает 150г/л. Для повышения выхода продукта созданы мутантные штаммы не способные утилизировать лизин. Данная технология получения лизина широко используется в США и Японии.
Получение триптофана. Химико-ферментативный способ получения триптофана состоит в прямой конденсации индола, аммиака и триптофана:
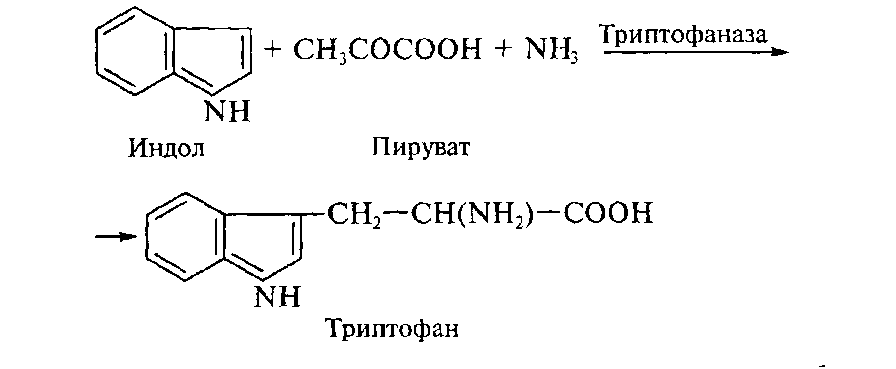
Реакция катализируется пиридоксальзависимой триптофан-индолилазой (триптофаназой), которая обнаружена у широкого круга бактерий. Основной функцией этого фермента является разрушение избыточного триптофана, однако в зависимости от условий культивирования (отвод образующегося триптофана, избыток ПВК и аммиака) его действие может быть обращено в сторону реакции конденсации.
Химико-энзиматический способ может быть использован для полученяия самых различных аминокислот. По сравнению с микробиологическим он более специфичен, не требует процедуры очистки аминокислот от побочных продуктов, клеток и компонентов культуральной среды. Однако по стоимости сырья и ферментативных препаратов он еще уступает микробиологическому способу.
Дата добавления: 2016-01-30; просмотров: 11413;
