Производство серной кислоты
Заводское получение серной кислоты относится к числу старейших крупномасштабных химических производств. Широко применяемые теперь процессы и аппараты разрабатывались и осваивались сначала применительно к технологии серной кислоты, а потом становились типовыми для изготовления многих крупнотоннажных химических продуктов. Именно в сернокислотном производстве 200 лет тому назад были внедрены первые башни с насадкой, которые представляют собой основной аппарат многих современных химических производств. Полочные и трубчатые химические реакторы (контактные аппараты) впервые были освоены в технологии серной кислоты, а затем стали типовыми для ряда других каталитических процессов. В сернокислотном производстве были освоены сначала гомогенный, а затем и гетерогенный катализ. Сотни индивидуальных веществ и различных комбинаций их были испытаны сначала для контактного окисления диоксида серы, прежде чем наиболее активные из них (платина, ванадиевые комплексы и др.) нашли применение в качестве окислительно-восстановительных катализаторов в ряде других производств.
СВОЙСТВА, ПРИМЕНЕНИЕ И СПОСОБЫ ПОЛУЧЕНИЯ
Свойства. Безводная серная кислота (моногидрат) представляет собой тяжелую маслянистую жидкость, которая смешивается с водой с выделением большого количества теплоты. Плотность Н2SO4 при 0°С равна 1,85 г/см3. Серной кислотой называют не только моногидрат, но и его водные растворы, a также растворы триоксида серы в моногидрате (H2SO4+nSO3), называемые олеумом. Чистая серная кислота бесцветна, техническая окрашена примесями в темный цвет.
Для производства, транспортировки, применения серной кислоты большое значение имеет изменение температуры плавления и температуры кипения ее в зависимости от концентрации.
| |
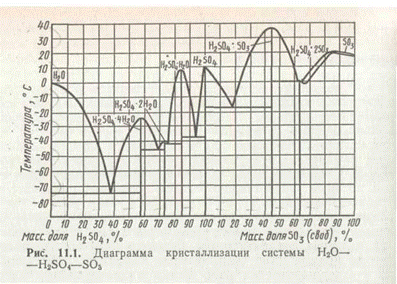 При увеличении массовой доли от 0% H2SO4 до 64,35% SO3 (своб) последовательно образуется шесть гидратов (рис. 1), являющихся индивидуальными химическими соединениями, которые взаимно нерастворимы в твердом виде, а образуют эвтектические смеси. В области концентраций SO3 от 64,35 до 100% при кристаллизации образуются твердые растворы. Все товарные сорта серной кислоты имеют концентрации, близкие к эвтектическим смесям.
При увеличении массовой доли от 0% H2SO4 до 64,35% SO3 (своб) последовательно образуется шесть гидратов (рис. 1), являющихся индивидуальными химическими соединениями, которые взаимно нерастворимы в твердом виде, а образуют эвтектические смеси. В области концентраций SO3 от 64,35 до 100% при кристаллизации образуются твердые растворы. Все товарные сорта серной кислоты имеют концентрации, близкие к эвтектическим смесям.
| |
| |
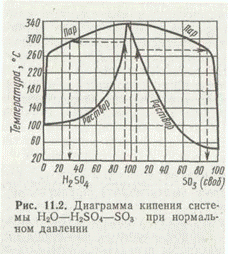
Изменение фазового равновесия паров с жидкостью для смесей Н2О—SO3 при атмосферном давлении показано на рис. 2. Смесь, соответствующая 98,3% Н2SO4 является азеотропной и
имеет единую температуру конденсации паров и кипения жидкости 336,6 °С. При небольшом изменении состава в обе стороны от азеотропной точки температура начала конденсации пара сильно отличается от температуры начала кипения жидкого раствора. Соответственно отличаются составы жидкой фазы и полученных из нее паров (или наоборот).
Пары серной кислоты при повышении температуры диссоциируют:
H2SO4 D H2O + SO2
и выше 400 °С уже содержат больше молекул SO3. Дальнейшее нагревание вызывает диссоциацию SO3:
2SO3 D O2 + 2SO2
Выше 700 °С в парах преобладает SO2, а выше 1000 °С SO3 диссоциирует почти полностью. Степень диссоциации меняется при изменении давления.
Серная кислота весьма активна. Она растворяет оксиды металлов и большинство чистых металлов, вытесняет при повышенной температуре все другие кислоты из солей. Она отнимает воду от других кислот, от кристаллогидратов солей и даже кислородных производных углеводородов. Дерево и другие растительные и животные ткани, содержащие целлюлозу, крахмал и сахар, разрушаются в концентрированной серной кислоте. В разбавленной кислоте целлюлоза и крахмал распадаются с образованием сахаров. При попадании на кожу человека концентрированная серная кислота вызывает ожоги.
Применение. Высокая активность серной кислоты в сочетании со сравнительно небольшой стоимостью производства предопределили громадные масштабы и чрезвычайное разнообразие ее применения.
Крупнейшим потребителем серной кислоты является производство минеральных удобрений: суперфосфата, сульфата аммония и др. Многие кислоты (например, фосфорная, уксусная, соляная) и соли производятся в значительной части при помощи серной кислоты.
Серная кислота широко применяется в производстве цветных и редких металлов, а также в металлообрабатывающей промышленности. Получение ряда красителей (для тканей), лаков и красок (для зданий и машин), лекарственных веществ и некоторые пластических масс также связано с применением серной кислоты. При помощи серной кислоты производят этиловый и другие спирты, некоторые эфиры, синтетические моющие средства, ряд ядохимикатов для борьбы с вредителями сельского хозяйства и сорными травами. Разбавленные растворы серной кислоты и ее солей применяют в текстильной, а также в других отраслях легкой промышленности. В пищевой промышленности серная кислота применяется при получении крахмала, патоки и ряда других продуктов. Транспорт использует свинцовые сернокислотные аккумуляторы. Серную кислоту используют для осушки газов и при концентрировании кислот. Наконец, серную кислоту применяют в процессах нитрования и при производстве большей части взрывчатых веществ.
При нитровании, а также в производстве этилового спирта из этилена, при концентрировании азотной кислоты и в ряде других процессов применяют серную кислоту концентрацией от 92 до 98%, а выводят из процесса разбавленную 50—80%-ную кислоту. Такую кислоту концентрируют выпариванием воды.
Способы получения. Еще в XIII в. серную кислоту получали в незначительных количествах термическим разложением железного купороса FeSO4×7H2O, поэтому и сейчас один из сортов серной кислоты называется купоросным маслом.
Серную кислоту производят двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце XIX и начале XX в. Контактный способ вытесняет нитрозный (башенный). В настоящее время свыше 95% всей кислоты производится контактным способом, позволяющим получать более концентрированную и чистую кислоту, чем нитрозным способом.
В контактном методе производства серной кислоты окисление диоксида серы в триоксид осуществляется на твердых контактных массах.
В нитрозном способе катализатором служат оксиды азота. Окисление SO2 происходит в основном в жидкой фазе и осуществляется в башнях с насадкой. Поэтому нитрозный способ по аппаратурному признаку называют башенным. Сущность башенного способа заключается в том, что газ, полученный при сжигании сернистого сырья, поступает в башенную систему, которая состоит из нескольких (четырех—семи) башен с насадкой. Башни с насадкой работают по принципу вытеснения при политермическом режиме. В башнях протекает ряд абсорбционно-десорбционных процессов, осложненных химическими превращениями. Нитрозным способом получают загрязненную примесями и разбавленную 75—77%-ную серную кислоту, которая используется в основном для производства минеральных удобрений.
В основных способах производства серной кислоты первой стадией является получение сернистого газа.
Дата добавления: 2016-01-20; просмотров: 1421;
