Отравление катализаторов
Под отравлением катализаторов понимается понижение, в пределе полное исчезновение активности катализаторов под действием небольшого количества веществ, называемых «ядами». Вследствие важности этого явления для практика катализа, а также довольно широкого распространения не правильных представлений о нем, целесообразно рассмотреть некоторые стороны теории процессов отравления катализаторов.
Детальные исследования показали необходимость дифференцировать различные типы явлений, объединяемых общим понятием «отравление». Прежде всего необходимо различать понятия «отравления» и «блокировки». При «отравлении» имеет место специфическое действие яда в отношении данного катализатора и данной реакции. «Блокировка» же представляет собой фактически механической процесс экранирования поверхности катализатора в результате отложения на ней примесей. Поэтому «блокировка» не специфична ни в отношении реакции, ни в отношении катализатора. Однако, естественно, «блокировка» сильнее сказывается на пористых катализаторах вследствие забивания устьев пор. Наиболее часто встречающимся видом «блокировки» катализаторов является отложение на их поверхности высокомолекулярных углеродистых соединений при проведении различного рода органических реакций, в частности крекинга. При «блокировке», в первом приближении, не меняется ни энергия активации катализатора, ни его селективность (исключая процессы, протекающие в диффузионной области), поскольку действие блокирующего вещества сводится к механическому выключению отдельных участков поверхности. «Блокировка», как правило, является обратимым процессом, если при удалении блокирующего вещества не происходит разрушения или дезактивация катализатора. Так, углеродистые отложения удаляются простым выжиганием (при 600-650°С в токе воздуха). Далее, из общего понятия «отравления», целесообразно выделить явления изменения структуры катализатора под действием примесей и связанное с этим падение активности катализатора. Например, при «отравлении» алюмосиликатных катализаторов водяным паром. В этом случае под влиянием водяного пара происходит рекристаллизация с перерождением структуры и уменьшением его внутренней поверхности. «Яд» способствует спеканию катализатора.
Собственно «отравление» катализатора может быть обратимым, когда после прекращения подачи «яда», катализатор восстанавливает свою активность, и не обратимым. Рассмотрим процесс обратимого «отравления» железного катализатора синтеза аммиака водяным паром При пропускании влажного газа (РИС.) активность быстро падает, примерно, в 6 раз, а после прекращения подачи Н2О меньше чем за 1 ч восстанавливается до исходной величины. Механизмы обратимого и необратимого «отравления» очень близки по своей сути, поэтому в дальнейшем будем рассматривать «отравление» катализаторов на примерах необратимого «отравления».
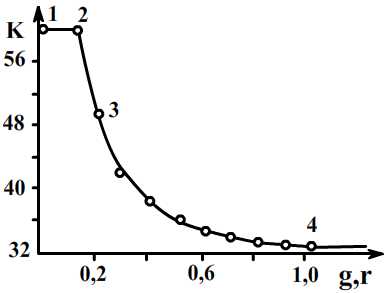
Зависимость константы скорости окисления SO2 на ванадиевом катализаторе от количества поданного мышьяка g.
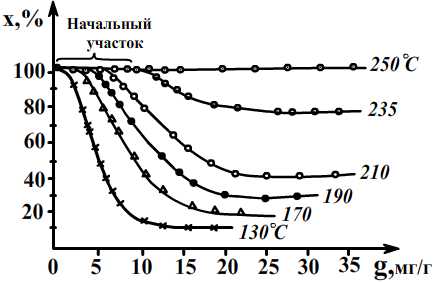
Изменение степени превращения H2S от количества его (g), поданного на палладиевый катализатор, и температуры.
Влияние аниона AS033- (g) на активность платинового катализатора в процессе гидрирования коричной кислоты.
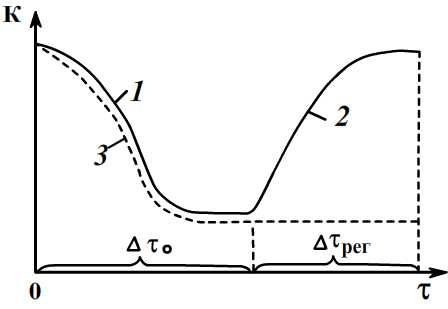
Изменение константы скорости реакции во времени: 1- при обратимом отравлении; 2-при восстановлении активности (поступает без яда); 3 – при необратимом отравлении; Δτ0 -период отравления; ΔτРЕГ -период регенерации активности.
Механизм собственно «отравления» связан с типом катализа и различается для процессов электронного катализа на полупроводниках и металлах и процессов ионного катализа. При ионном катализе действие «яда» сводится к связыванию расположенных на поверхности каталитически активных ионов. Наиболее сложен механизм действия «ядов» на металлические и полупроводниковые катализаторы. Металлы, особенно благородные, значительно более чувствительны к «ядам», чем оксидные полупроводниковые катализаторы.
Мэкстед, рассматривая «отравление» металлических катализаторов, делит «яды» по механизму действия на 3 группы: 1) молекулы, содержащие элементы второй подгруппы 5 и 6 групп периодической системы, а именно N, P, As, O, S, Se, Te, включая свободные элементы, кроме азота; 2) соединения металлов; 3) молекулы, содержащие кратные связи, например оксид углерода, цианистые соединения и др. Ядовитость первой группы соединений Мэкстед связывал с наличием у них неподеленных электронных пар, вследствие чего образуются прочные хемосорбционные связи «яда» с металлом, обуславливающие большую продолжительность жизни «яда» в адсорбированном состоянии. «Яд», покрывая поверхность катализатора, дезактивирует его. Роль неподеленных электронных пар в механизме «отравления» подтверждается тем, что соединения, в которых они отсутствуют, не токсичны. Необходимо иметь в виду, что нетоксичные соединения под влиянием реагентов могут переходить в токсичные; например, арсенаты в условиях гидрирования переходят в арсины.
Если потенциально ядовитый элемент находится в состоянии, при котором невозможно образование им связей с катализатором (экранирован от катализатороа), то такие соединения не ядовиты. Такой факт может быть в случаях, когда токсичный элемент обладает полностью поделенным электронным октетом, его валентные связи полностью насыщены. Если же элемент содержит неподеленные внешние электронные пары или неиспользованные валентные орбиты, то он может образовывать поверхностные соединения с катализатором. Так, при каталитическом гидрировании на Ni, Pt или Pd токсичны фосфин (РН3), сульфит-ион (SO3-2), органический сульфид. Известно, что в гомеополярных (атомных) молекулах сущность ковалентной связи заключается в том, что соединяющиеся атомы восполняют свои наружные электронные слои до 8 электронов (устанавливается состояние, приближающееся к оболочке инертных газов) путем образования общих пар. Два электрона, общих для двух атомов, называют поделенной электронной парой.
(структура соединений)
«Отравление» катализаторов ионами металлов свойственно платиновым, палладиевым и другим катализаторам из благородных металлов. Было обнаружено, что каталитическая активность платиновых и палладиевых катализаторов гидрирования понижается в присутствие ионов ртути, свинца, висмута, олова, кадмия, меди, железа и некоторых других. Сравнение токсичности ионов различных металлов по отношению к платиновым катализаторам гидрирования приводит к заключению, что токсичность свойственна, по-видимому, тем металлам, у которых все 5 орбит d–оболочки, непосредственно следующих за s- и p–валентными орбитами, заняты электронными парами или, по крайней мере, одиночными d–электронами. Так как токсичность не наблюдается, если имеются незанятые электронами d–уровни или когда d–орбиты вообще отсутствуют, то вероятно, что d–электроны участвуют в образовании интерметаллической связи между токсичным металлом и поверхностью катализатора.
Каталитические «яды» третьей группы – соединения, обладающие кратными связями, могут рассматриваться как «яды» только при совместном присутствии их с другими реагентами, поскольку сами по себе они претерпевают многочисленные превращения на катализаторах. Очевидно, что тормозящее действие этих соединений на другие реакции объясняется их высокими адсорбционными коэффициентами из-за наличия в молекулах кратных связей.
Отравление полупроводниковых катализаторов.
Подобно катализаторам «яды» обладают селективностью: соединения мышьяка являются сильным «ядом» для Pt при гидрировании, но влияет слабее на ее каталитические свойства в реакции разложения Н2О2. Висмут в очень малых концентрациях – «яд» для железных гидрирующих катализаторов, но активирует Fe при каталитическом окислении NH3 в NO. Выключая те или иные центры, действием яда можно затормозить реакцию на желаемой промежуточной стадии, не доводя ее до конца. Например, при гидрировании хлористого бензоила в бензольном растворе образуется толуол:
C6H5COCl + Н2 ® C6H5CHO + HCl
C6H5CHO + Н2 ® C6H5CН2OH
C6H5CН2OH + Н2 ® C6H5CН3 + Н2О
Добавление к бензолу обработанного серой хинолина или бромтиофена позволяет остановить реакцию на стадии альдегида (C6H5CHO).
Селективность Ni и Pt катализаторов в реакции неполного гидрирования тройных связей усиливается в результате дезактивации небольшими добавками ряда веществ или их ионов (солей): Ag, Cu, Cd, Hg, Al, Sn, Pb, Th, As, Sb, Bi, S, Se, Te.
Количество «яда», необходимое для «отравления» катализатора, обычно чрезвычайно мало. Так, для Ni в реакциях гидрирования HCN «ядовит» в концентрациях 1:20 000 000; Н2S – 1:300 000; сулема – 1:2 000 000 частей.
Эффект отравления количественно можно охарактеризовать коэффициентом «отравления» «aт» (или коэффициентом токсичности «яда»). Опыт показывает, что активность катализатора в области «отравления» меняется линейно с ростом концентрации «яда» и только в области относительно больших концентраций, когда катализатор близок к насыщению ядом и практически полностью «отравлен», наблюдается отклонение от линейной зависимости. Если обозначить: А0 и А – исходная в отсутствии «яда» и остаточная активность отравленного катализатора; G – количество «яда», то зависимость активности от количества «яда» можно выразить следующим уравнением:
А = А0×(1- aт ×G)
Коэффициент отравления показывает долю занятой молекулами «яда» активной поверхности катализатора, отнесенную к единице массы «яда»:
aт = (А0 - А)/(А0 ×G), где Sт = (А0 - А)/А0 – доля поверхности, занятой «ядом». Коэффициент отравления зависит от свойств катализатора, типа реакции и яда». Чем больше размеры молекулы, тем больше токсическое действие. В табл. Даны величины aт для различных «ядов» на Ni и Pt катализаторах. Увеличение токсичности по мере сложности молекулы названо Мэкстедом якорным эффектом, который может быть объяснен тем, что молекула «яда», присоединяясь к активному центру токсическим атомом, блокирует соседние активные центры. Число заблокированных центров растет с увеличением размеров молекулы.
Для расчета «отравляемости» используют и другие уравнения:
aт = (2,3/G)×lg(k0/k), где k0 и k – константы скорости в отсутствии «яда» и отравленного катализатора.
Рис. Гидрирование циклогексана на Pt, «отравленной» AsH3.
Как следует из рис. первые порции «яда» снижают каталитическую активность на 70-80% от первоначальной величины; после чего как правило, токсическая активность снижается и кривая полого спадает к оси абцисс. Начальный участок на кривой «отравления» приближенно можно считать линейным. Объяснение высокой токсичности первых порций «яда» заключается, по-видимому, в том, что доля каталитически активной поверхности может составлять незначительную часть от всей адсорбирующей реагирующими веществами поверхности. Каталитический «яд», подавляя активность, незначительно снижает адсорбционную поверхность катализатора. Так, для Fe-катализатора синтеза аммиака каталитически активная поверхность составляет 0,1% по отношению к адсорбционной поверхности.
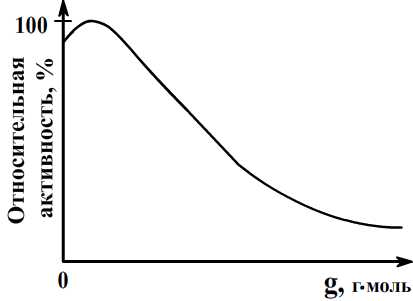
В некоторых случаях на кривой А/А0 = f(G) появляется в области очень малых концентраций «яда» характерный максимум (рис.). Механизм активирования малыми дозами «яда» может быть объяснен образованием примеси в решетке катализатора. Количественное объяснение влияния примесей на каталитическую активность дается электронной теорией.
Иногда при поглощении первых порций «яда» реакция, требующая высокой активности катализатора, прекращается, а не требующая особой активности может продолжаться. Данный факт свидетельствует о том, что каталитически активная часть поверхности составляет незначительную долю от всей его поверхности и для разных процессов оказываются активными различные участки поверхности катализатора. Поэтому изучение действия «яда» приводит к подтверждению того, что поверхность катализатора неоднородна, состоящая из совокупности адсорбционных центров с различной энергией и только некоторые из них являются одновременно и каталитически активными центрами.
В кипящем или движущимся слоях катализатора вследствие трения прочных гранул друг о друга сорбированные молекулы «яда» могут стираться и уноситься с потоком газа. Чем менее чувствителен катализатор к «ядам», тем меньшие затраты требуются на очистку от них исходного газа и тем более длительный срок может работать катализатор.
Химическое «отравление» может быть обусловлено образованием на поверхности неактивных химических соединений (сульфатов, арсенатов, хлоридов). Оно может быть обусловлено изменением работы выхода электрона (например, действие HgCl2 при разложении Н2О2 на Pt), сорбцией на активных центрах, выключая их из работы.
Кроме химического «отравления» активность катализатора может уменьшаться в результате спекания кристаллов, снижения количества активной массы, улетучивания (V2O5; Р2O5 в ванадиевых и фосфорных соединениях), затруднительного подхода молекул реагентов к рабочей поверхности вследствие механического забивания пор (например, отложение углерода в порах катализаторов крекинга).
В зависимости от вида «яда» падение активности может происходить различными путями: Рис. Снижение активности катализатора при сорбции хинолина на алюмосиликатном катализаторе.
Небольшая доля адсорбированного «яда» может привести к значительному снижению активности, например, при разложении Н2О2 на Pt присутствие 1 г HgCl2 в 7 раз уменьшает активность . Для этой группы зависимость А= f(G) будет выглядеть следующим образом: (рис.).
Потеря активности с введением «яда» может выражаться и такой зависимостью (рис.). Н участке mn падение активности не происходит, так как снчала «яд» сорбируется на каталитически не активных центрах. Активность может быть восстановлена при обратимом «отравлении».
Кумулятивное (накапливающееся) «отравление» выражается в медленной прогрессирующей дезактивации катализаторов под действием малых количеств «ядов», содержащихся в реагентах. Во избежания этого в заводских условиях перед реактором с катализатором помещают специальные дополнительные катализаторы (форконтакты) для улавливания следов «яда». Иногда подтравливание катализаторов дезактивирующими добавками не только снижает их активность, но и вообще выключает некоторые функции катализаторов. В результате многостадийную реакцию можно остановить на какой-либо из промежуточных стадий. Такое «отравление» катализаторов названо благоприятствующим.
Из факторов, от которых зависит «отравление» катализаторов, следует отметить: t, P и способ приготовления катализаторов. Повышение температуры, как правило, снижает «отравляемость». Например, V2O5 очень чувствителен к As, но при 500°С и выше он не «отравляется». При температурах выше 700-1000°С случаи «отравления» уже почти не известны, что объясняется тем, что при таких температурах связи между «ядом» и поверхностными атомами катализатора непрочны и «отравление» приобретает характер обратимого. Способ приготовления сказывается на величине удельной поверхности катализатора, а если последняя больше, тем ее труднее «отравить».
Внешним признаком процесса спекания кристаллического пористого, в частности дисперсного, тела служит уменьшение его внешних размеров, соответственно и уменьшение пористости и увеличение плотности. Сущность явления заключается в самопроизвольном заполнении веществом, в результате повышения подвижности элементов его решетки при достаточно высоких температурах, свободного пространства внутри зерен и между ними. При этом уменьшается площадь поверхности гранул и возрастает поверхность контакта между ними. Движущей силой процесса спекания является уменьшение термодинамического потенциала системы за счет уменьшения поверхности и снятия искажений и напряжений в кристаллической решетке. Снижение поверхности в процессе спекания уменьшает поверхностную и, следовательно, полную энергию системы. Удельная поверхность пор обратно пропорциональна квадрату ее радиуса, поэтому при наличии в теле пор разного размера движущая сила процесса зарастания мелких пор больше, чем крупных. При этом возможно уменьшение объема мелких пор и их количества за счет увеличения объема крупных пор, поскольку это приводит к уменьшению термодинамического потенциала.
По Френкелю процесс спекания состоит из двух этапов: 1) первый - протекает с постоянной скоростью и зависит лишь от поверхностного натяжения (s), вязкости (m) и характера среды, окружающей пору:
dr/dt = 3/4×s/m, где r – радиус поры; t - время.
Время полного зарастания поры: t =4/3×m× r0/s, где r0 – первоначальный радиус поры.
Время «полного слияния» двух частиц сферической формы имеет такую же величину, как и время зарастания поры того же радиуса.
Однако эта теория не учитывает: 1) разнообразие гранулометрического состава; 2) наличие пор разных размеров; 3) различие в вязком течении кристаллических и жидких тел.
Пинес показал, что скорость изменения радиуса поры в процессе спекания может быть выражена уравнением:
dr/dt = - (2×s/r2) × [d3×D/(k×T)], где d- постоянная кристаллической решетки; D – коэффициент диффузии; k - постоянная Больцмана; Т-температура. По этому уравнению значение скорости примерно в (d1,5/r)2 меньше, чем по уравнению Френкеля. Если по Френкелю со временем линейно меняется радиус поры, то по Пинесу – линейно изменяется объем пор.
V=4/3×p×r3, dV= K×dt, 4/3×p×3×dr2 = K×dt
По Пинесу: r2×dr = -2×s ×d3×D/(k×T) × dt
Зарастание пор может привести к уменьшению их количества в единице объема материала и к соответствующему замедлению процесса спекания в целом. Скорость спекания значительно уменьшается при интенсивном росте зерен.
Дата добавления: 2016-01-18; просмотров: 9579;
