Набухание и растворение биополимеров. Механизм набухания. Влияние различных факторов на величину набухания.
Растворение полимеров с линейными гибкими молекулами сопровождается набуханием — процессом, в котором происходит не только диффузия молекул растворяемого вещества в растворителе (как у низкомолекулярных веществ), но, главным образом, диффузия молекул растворителя в высокомолекулярное соединение. Это •связано с тем, что макромолекулы в обычных аморфных полимерах упакованы сравнительно неплотно и в результате теплового движения гибких цепей между ними периодически образуются весьма малые пространства, в которые могут проникать молекулы растворителя, обладающие малыми размерами и большой подвижностью
Набухание и растворение полимеров.Процесс растворения ВМС протекает самопроизвольно, но в течение длительного времени, и ему часто предшествует набухание полимера в растворителе. Полимеры, макромолекулы которых имеют симметричную форму, могут переходить в раствор, предварительно не набухая. Например, гемоглобин, печеночный крахмал – гликоген при растворении почти не набухают, а растворы этих веществ не обладают высокой вязкостью даже при сравнительно больших концентрациях. В то время, как вещества с сильно асимметрическими вытянутыми молекулами при растворении очень сильно набухают (желатин, целлюлоза, натуральный и синтетические каучуки).
Набухание – это увеличение массы и объема полимера за счет проникновения молекул растворителя в пространственную структуру ВМС. Причиной набухания является большая разница в размерах молекул растворяемого вещества и растворителя и, как следствие этого, большое различие в скоростях их диффузии. Поэтому при набухании вначале происходит практически односторонняя диффузия молекул растворителя в пространственную сетку полимера, имеющая ту же природу, что и осмос растворителя в осмотическую ячейку через поры полупроницаемой мембраны. Оба процесса вызываются стремлением системы к выравниванию концентраций компонентов.
Механизм набухания сводится к проникновению молекул растворителя в ближайшие слои полимера и сольватации соответствующих участков полимерной цепи. В результате этого макромолекулы «разрыхляются», что облегчает дальнейшее проникновение молекул растворителя и увеличение массы и объема полимера.Различают два вида набухания: неограниченное, заканчивающееся полным растворением ВМС (например, набухание желатины в воде, каучука в бензоле, нитроцеллюлозы в ацетоне) и ограниченное, приводящее к образованию набухшего полимера – студня (например, набухание целлюлозы в воде, желатина в холодной воде, вулканизованного каучука в бензоле). Студень представляет собой пространственную сетку, состоящую из связанных между собой макромолекул полимера и заполненную молекулами растворителя.
Степень ограниченности процесса набухания и возможность самопроизвольного растворения определяются соотношением энергии связи в решетке полимера и энергии сольватации полимерной цепи с учетом энтропийного фактора.
Весь процесс набухания и растворения ВМС можно условно разделить на ряд стадий (рис. 43).
Рис 43. Последовательные стадии (а – г) растворения ВМС в низкомолекулярной жидкости

На начальной стадии (рис.43а) система состоит из двух компонентов: полимера и низкомолекулярной жидкости. Переход а®б характеризуется интенсивным проникновением молекул низкомолекулярной жидкости в структуру полимера и сольватацией полимерной цепи, сопровождающийся выделением теплоты (DН<0). Изменение энтропии по сравнению с энтальпийным фактором незначительно. При этом объем полимера возрастает, но общий объем системы полимер-растворитель уменьшается. Это явление называется контракцией, а выделение теплоты говорит о физико-химической природе процесса.Переход б®в представляет собой начальный этап распределения макромолекул полимера по всему объему растворителя и характеризуется возрастанием энтропии системы вследствие роста числа возможных конформаций. Энтальпия системы если и изменяется, то незначительно. На данном этапе происходит обычно основное увеличение объема и массы полимера. Это результат дальнейшего проникновения молекул растворителя в полимерную сетку, ее разрыхление и связанное с этим частичное освобождение макромолекул. Отдельные макромолекулы начинают отрываться друг от друга и переходить в слой низкомолекулярной жидкости.Ограниченное набухание заканчивается на стадии б или в образованием студня. Дальнейшее развитие процесса – неограниченное набухание – приводит к растворению полимера, т. е. образованию раствора ВМС (рис.43г). Переход в®г происходит в результате сил диффузии и характеризуется значительным увеличением энтропии системы. При этом макромолекулы ВМС равномерно распределяются по всему объему низкомолекулярного растворителя, образуя истинный раствор. Так как растворение полимеров главным образом обусловлено ростом энтропии, то и устойчивость растворов ВМС объясняется в основном энтропийным фактором.Набухание и, следовательно, растворение ВМС зависят от природы растворителя и полимера, строения макромолекул полимера, температуры, присутствия электролитов, а также от рН среды (для полиэлектролитов).Процессы набухания и растворения ВМС являются избирательными процессами. Другими словами для образования раствора ВМС необходимо его сродство с растворителем (лиофильность). Неполярные полимеры хорошо набухают (растворяются) в неполярных растворителях (каучук в бензоле или бензине) и не набухают в полярных. Полярные полимеры лучше набухают (растворяются) в полярных жидкостях (белок в воде) и не набухают в неполярных. Ввиду сродства полимера с растворителем, при набухании и растворении большая часть растворителя “связывается” в сольватные (гидратные) оболочки. Особенно это характерно для полярных макромолекул в водной среде. И поскольку макромолекулы обладают большой поверхностью, то для неограниченного набухания (растворения) даже в лиофильной системе требуется достаточное количество жидкости. Иначе процесс набухания может остановится на стадии ограниченного набухания, т. е. образования студня.Существенную роль в набухании играет строение макромолекул полимера. Например, полимеры с длинными жесткими цепями и большим количеством полярных групп хорошо набухают, но не растворяются даже в соответствующем растворителе (целлюлоза в воде). Если полимер растворяется в жидкости не достаточно хорошо, то также образуется студень.Температура на эти процессы влияет в соответствии с принципом Ле Шателье. Поскольку набухание сопровождается выделением теплоты на первом этапе, то с повышением температуры степень набухания, а так же растворимость полимера, уменьшаются. На второй стадии набухание может стать эндотермическим процессом. Следовательно, в этом случае набухание с возрастанием температуры увеличивается. Например, если в холодной воде желатина набухает ограниченно, то с повышением температуры – неограничено, т. е. растворяется. При охлаждения полученного раствора снова образуется студень. Однако скорость набухания (растворения) полимеров с увеличением температуры растет ввиду увеличения скорости диффузии.Действие ионов электролитов на набухание полярного ВМС связано с их способностью к гидратации. Поскольку анионы гидратируются больше, чем катионы, то последние влияют на набухание этих полимеров незначительно. По способности уменьшать набухание анионы располагаются в так называемый лиотропный ряд, или ряд Гофмейстера (при одном и том же катионе):
CNS– < J– < Br– < 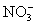 < Cl– < CH3COO– <
< Cl– < CH3COO– < 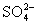
Ионы CNS– усиливают набухание вследствие того, что слабо гидратируясь, они хорошо адсорбируются на макромолекулах ВМС. А ионы 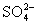 процесс набухания тормозят, так как сульфат – ионы сильнее всех анионов этого ряда гидратируются, уменьшая этим количество “свободной” (не связанной в гидратные оболочки) воды.Влияние рН среды особенно значительно для высокомолекулярных электролитов (белков, нуклеиновых кислот, производных целлюлозы и крахмала). Минимум набухания отмечается в изоэлектрической точке, поскольку в ней суммарный электрический заряд макромолекул белков и, соответственно, степень их гидратации минимальны. При более низких или более высоких значениях рН увеличивается ионизация функциональных групп, что приводит к расталкиванию одноименно заряженных участков полимерной цепи и её разрыхлению. Вследствие этого молекулы воды легче проникают в пространство между цепями, что отражается на величине набухания в сторону ее увеличения
процесс набухания тормозят, так как сульфат – ионы сильнее всех анионов этого ряда гидратируются, уменьшая этим количество “свободной” (не связанной в гидратные оболочки) воды.Влияние рН среды особенно значительно для высокомолекулярных электролитов (белков, нуклеиновых кислот, производных целлюлозы и крахмала). Минимум набухания отмечается в изоэлектрической точке, поскольку в ней суммарный электрический заряд макромолекул белков и, соответственно, степень их гидратации минимальны. При более низких или более высоких значениях рН увеличивается ионизация функциональных групп, что приводит к расталкиванию одноименно заряженных участков полимерной цепи и её разрыхлению. Вследствие этого молекулы воды легче проникают в пространство между цепями, что отражается на величине набухания в сторону ее увеличения
Набухание полимеров сопровождается возникновением давления, которое назвали давлением набухания (» 5×105–10×105 Па). Механизм его возникновения подобен механизму возникновения осмотического давления. Это давление легко обнаруживается, когда какое-либо препятствие мешает увеличению объема полимера.
83.Полиэлектролиты. Изоэлектрическая точка и методы ее определения. Высаливание биополимеров из растворов. Коацервация и ее роль в биологических системах.
Полиэлектролиты – это полимеры, макромолекулы которых содержат функциональные группы, способные к электролитической диссоциации. В зависимости от природы ионогенных групп полиэлектролиты, как и низкомолекулярные электролиты, могут быть сильными и слабыми кислотами, основаниями, солями. Сильной поликислотой является, например, поливинилсульфоновая кислота.
Полиэлектролиты представляют собой водные растворы органических полимеров, которые используются, как в качестве исходных коагулянтов, так и в качестве коагулирующих агентов. В общем случае, полиэлектролиты имеют следующую классификацию:Анионные - ионизация в растворе для образования вакансий с отрицательным зарядом, наряду с образованием молекул полимера.Катионные - ионизация для образования вакансий с положительным зарядом.Неионные - чрезвычайно слабая ионизация.Первичные полиэлектролитные коагулянты являются катионными, содержащими материалы с относительно низкой молекулярной массой (как правило, менее 500,000). Плотность катионного заряда (имеющиеся положительно заряженные вакансии) чрезвычайно высокаКоагулирующие агенты, являющиеся полиэлектролитами, могут иметь анионный, катионный или околонейтральный заряд. Их молекулярная масса сравнительно высокая (в диапазоне до 20,000,000 единиц). Их первоначальное действие осуществляется через связи между частицами.Эффективность первичных полиэлектролитных коагулянтов в значительной степени напрямую зависит от природы и количества замутняющих частиц, которые подвергаются коагуляции, а также от возможности создания турбулентных условий (смешивание) в ходе процесса коагуляции.Сравнение полиэлектролитов и неорганических коагулянтовНе смотря на то, что их отдельное применение не практикуется, полиэлектролиты обладают несколькими преимуществами над неорганическими коагулянтами. Эти преимущества заключаются в следующемВо время осветления жидкости имеется возможность снижения уровня образующегося осадка на 50 -90%Образующийся осадок лучше поддается обезвоживанию и содержит меньше воды.Полимерные коагулянты не влияют на уровень pH. Таким образом, потребность в щелочных химикатах, таких как известь, каустик или кальцинированная сода снижается или исключается.Полимерные коагулянты не увеличивают концентрации общего количества растворённых веществ.Игнорирование использования коагулянта может привести к переходу солей железа или сульфата алюминия в виде примесей в следующую стадию цикла. Данная проблема частично или полностью устраняется при использовании полимерных коагулянтов Изоэлектрическая точка (pI) — кислотность среды (pH), при которой определённая молекула или поверхность не несёт электрического заряда.Амфотерные молекулы (цвиттер-ионы) содержат как положительные, так и отрицательные заряды, наличием которых определяется pH раствора. Заряд различных функциональных групп таких молекул может меняться в результате связывания или, наоборот, потери протонов H+. Величина изоэлектрической точки такой амфотерной молекулы определяется величинами констант диссоциациикислотной и осно́вной фракций:
· 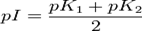
Растворимость амфотерных молекул, как правило, является минимальной при pH равной или близкой к изоэлектрической точке pI. Часто они в своей изоэлектрической точке выпадают в осадок. Многие биологические молекулы, такие как аминокислоты и белки, являются по своей природе амфотерными, так как содержат и кислотные, и осно́вные функциональные группы. Общий заряд белка определяется боковыми группами аминокислот, которые могут быть положительно- или отрицательно-заряженными, нейтральными или полярными. Общий заряд белка при pH ниже изоэлектрической точки является положительным. Наоборот, при pH выше изоэлектрической точки общий заряд белка — отрицательный. В самой изоэлектрической точке сумма положительных зарядов на белковой молекуле равна сумме отрицательных зарядов, поэтому будучи помещена в электрическое поле такая молекула не двигается.Изоэлектрическое фокусирование белков используется для разделения смеси белков в полиакриламидном геле в градиенте pH в зависимости от величины их изоэлектрических точек.Коацервация — расслоение коллоидной системы с образованием коллоидных скоплений (коацерватов) в виде двух жидких слоев или капель. Коацервация может возникать в результате частичной дегидратации дисперсной фазы коллоида, являясь начальной стадией коагуляции.Сущность явления коацервации заключается в отмешивании из однородного коллоидного раствора слоя или капель, связанном с переходом от полного смешивания к ограниченной растворимости.Коацерватные капли — это сгустки подобно водным растворам желатина. Образуются в концентрированных растворахбелков и нуклеиновых кислот. Коацерваты способны адсорбировать различные вещества. Из раствора в них поступают химические соединения, которые преобразуются в результате реакций, проходящих в коацерватных каплях, и выделяются в окружающую среду.Коацерваты имеют важное значение в ряде гипотез о происхождении жизни на Земле. Коацерваты в таких гипотезах представляют некие праорганизмы (протоорганизмы).Каждая молекула имеет определенную структурную организацию (атомы, входящие в ее состав, закономерно расположены в пространстве). Вследствие этого в разноатомных молекулах образуются полюсы с различными зарядами. Например, молекула воды H2O образует диполь, в котором одна часть молекулы несет положительный заряд, а другая — отрицательный. Кроме этого, некоторые молекулы (например, соли) в водной среде диссоциируют на ионы.В силу таких особенностей химической организации вокруг молекул образуются водные «рубашки» из определенным образом ориентированных молекул воды. Молекулы, окруженные водной «рубашкой», могут объединяться, образуя многомолекулярные комплексы — коацерваты. Коацерватные капли возникают также при простом смешивании разнообразных полимеров. При этом полимерные молекулы «собираются» в многомолекулярные фазово-обособленные образования.
Дата добавления: 2016-01-16; просмотров: 5851;
