Кинетика коагуляции под действием электролитов. Скрытая, медленная и быстрая коагуляция. Порог коагуляции, его определение. Правило Гарди и Шульце.
Коагуляция - процесс разрушения коллоидных систем за счет объединения частиц в более крупные агрегаты (слипание частиц). Коагуляция происходит под влиянием внешних факторов: температуры, света, электрического тока, механического воздействия, действия электролитов.Современная теория устойчивости и коагуляции коллоидных систем была разработана Б. В. Дерягиным и Л. Д. Ландау. В основе этой теории лежат представления о силах молекулярного притяжения, с одной стороны, и силах электростатического отталкивания, с другой.Устойчивыми системы являются за счет сил отталкивания частиц друг от друга. Но если частицы обладают достаточной энергией, чтобы преодолеть эти силы, то частицы объединяются, начинается процесс коагуляции.
Процесс коагуляции протекает в две стадии:
1) скрытая: нельзя невооруженным глазом зафиксировать изменение системы;
2) явная: наблюдаются внешние признаки коагуляции - изменение цвета, помутнение, образование осадка.
В случае гидрофобных золей первая стадия проходит быстро и переходит в явную. В случае гидрофильных золей первая стадия медленная, иногда не переходит в явную.Наибольший интерес представляет коагуляция под действием электролитов. Коагуляцию золей вызывает лишь тот ион электролита, который имеет заряд, противоположный заряду гранулы. Чтобы вызвать коагуляцию золя, необходимо концентрацию прилитого электролита в золе довести до определенной величины. Та минимальная молярная концентрация электролита, при которой начинается коагуляция золя объемом 1 м3, называется порогом коагуляции:
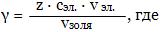 γ - порог коагуляции, моль/м3,z - количество валентных электронов иона, cэл - концентрация электролита, моль/м3,vэл - объем прилитого электролита, м3,vзоля - объем золя, м3.
γ - порог коагуляции, моль/м3,z - количество валентных электронов иона, cэл - концентрация электролита, моль/м3,vэл - объем прилитого электролита, м3,vзоля - объем золя, м3.
Величина, обратная порогу коагуляции, называется коагулирующей способностью электролита.
При экспериментальном изучении коагуляции золей электролитами было установлено правило Шульце-Гарди (правило значности): с повышением заряда коагулирующего иона его коагулирующая способность повышается, т.е. понижается порог коагуляции.
Коагулирующая способность ионов одного и того же заряда может быть выражена лиотропными рядами, в которых ионы расположены по убывающей коагулирующей активности:
Li+ > Na+ > K+ > Rb+ > Cs+
Mg2+ > Ca2+ > Sr2+ > Ba2+
Cl- > Br- > NO3- > I-
Различие в коагулирующей способности ионов одинаковых зарядов связано с неодинаковой степенью их гидратации. Чем сильнее гидратирован ион, тем слабее его притяжение к противоположно заряженной поверхности, тем слабее его коагулирующая способность.
Для органических электролитов применяется правило Траубе: с увеличением углеводородного радикала на одну метиленовую группу (-СН2-) коагулирующая способность возрастает в 3-4 раза.
С процессом коагуляции связано несколько явлений:
1) Перезарядка золей - изменение заряда гранулы при добавлении к золю электролита, содержащего многозарядные ионы. 2) При коагуляции смесью электролитов может наблюдаться: а) явление аддитивности - коагулирующее действие ионов суммируется. Например, NaCl и KCl. б) явление антагонизма - снижение коагулирующего действия одного иона в присутствии другого. в) синергизм (явление сенсибилизации) - усиление коагулирующего действия смеси электролитов. Один ион как бы повышает (сенсибилизирует) чувствительность фазы к коагулирующему действию другого иона. 3) Явление привыкания: при добавлении электролита малыми порциями и через большие промежутки времени происходит задержка коагуляции или она может не наступить совсем. 4) Взаимная коагуляция золей происходит между двумя золями, гранулы которых противоположно заряжены, без участия электролита.5) Явление пептизации: осадок, который получается вследствие коагуляции, можно привести во взвешенное состояние под действием электролита - пептизатора (FeCl3, AlCl3, HCl).Устойчивость коллоидной системы можно повысить, введя в нее небольшое количество ВМС (высокомолекулярных соединений). Так, при добавлении к золю золота небольшого количества желатина, золь становится более устойчивым и не коагулирует даже при добавлении к нему электролитов. Это явление было названо защитным действием или коллоидной защитой, а добавляемые вещества - защитными. К защитным веществам в водных средах относятся:1) белковые: желатин, альбумин и т.д.; 2) мыла и мылообразующие вещества;3) высокомолекулярные углеводы - крахмал и др.; 4) глюкозиды и дубильные вещества.
Для количественной характеристики защитного действия введена величина, названная золотым числом. Это минимальное количество сухого защитного вещества (мг), которое может защитить от коагуляции 10 мл стандартного раствора золя золота при добавлении к нему 1 мл 10% раствора NaCl.Для защиты коллоидных систем необходимы очень небольшие количества защитных веществ. Например, желатина - 0,08 мг, альбумина - 0,15 мг, крахмала - 25 мг.Кроме золотого числа, можно определить защитные действия веществ по отношению к золю серебра (серебряное число), конго рубинового (рубиновое число) и т.д. Правило Шульце - Гарди к защищенным лиофобным золям не применимо, так как они резко повышают свою устойчивость.
Дата добавления: 2016-01-16; просмотров: 3782;
