Чередование зон коагуляции. Коагуляция золей смесями электролитов. Взаимная коагуляция коллоидов.
Медленная коагуляция – это когда электролита введено в таком
количестве, что небольшой барьер отталкивания сохраняется ( DU ),
здесь не все сталкивающие частицы коагулируют. Скорость ее зависит
от концентрации электролита.Быстрая коагуляция – имеет место при полном исчезновении
энергетического барьера, здесь каждое столкновение частиц приводит к
коагуляции. Скорость быстрой коагуляции u – не зависит от концен-
трации электролита.
Различают две стадии коагуляции.
1 стадия – скрытая коагуляция. На этой стадии частицы укрупняются, но еще не теряют своей седиментационной устойчивости.
2 стадия - явная коагуляция. На этой стадии частицы теряют свою седиментационную устойчивость. Если плотность частиц больше плотности дисперсионной среды, образуется осадок.
Правила коагуляции:
1. Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию.
Минимальная концентрация электролита, при которой начинается коагуляция, называется порогом коагуляции Ck.
Иногда вместо порога коагуляции используют величину VK, называемую коагулирующей способностью. Это объем золя, который коагулирует под действием 1 моля электролита:
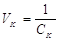 ,
,
т.е. чем меньше порог коагуляции, тем больше коагулирующая способность электролита.
2. Коагулирующим действием обладает не весь электролит, а только тот ион, заряд которого совпадает по знаку с зарядом противоиона мицеллы лиофобного золя. Этот ион называют ионом–коагулянтом.
3. Коагулирующая способность иона–коагулянта тем больше, чем больше заряд иона.
Правило устанавливает, что коагулирующие силы иона тем больше, чем больше его валентность. Экспериментально установлено, что ионы с высшей валентностью имеют значение порога коагуляции ниже, чем ионы с низшей. Следовательно, для коагуляции лучше брать ионы с высшей степенью окисления. Если валентность ионов одинакова, то коагулирующая способность зависит от размеров и степени гидратации ионов. Чем больше радиус иона, тем больше его коагулирующая способность. По этому правилу составлены лиотропные ряды. Органические ионы-коагулянты, как правило, лучше коагулируют гидрозоли, чем неорганические, т.к. они легко поляризуются и адсорбируются. С точки зрения двойного электрического слоя (ДЭС) считается, что коагуляция идет в том случае, когда z-потенциал > 30 мВ.
Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус. Причина с одной стороны, в большой поляризуемости ионов наибольшего радиуса, следовательно, в их способности притягиваться поверхностью, состоящей из ионов и полярных молекул. С другой стороны, чем больше радиус иона, тем меньше, при одной и той же величине заряда, гидратация иона. Гидратная же оболочка уменьшает электрическое взаимодействие. Коагулирующая способность органических ионов больше по сравнению с неорганическими ионами.При увеличении концентрации иона–коагулянта z – потенциал мицеллы золя уменьшается по абсолютной величине. Коагуляция может начинаться уже тогда, когда z – потенциал снижается до 0,025 – 0, 040 В (а не до нуля).При коагуляции золя электролитами различают концентрационную и нейтрализационную коагуляцию.
Концентрационная коагуляция имеет место, когда она происходит под действием индифферентного электролита вследствие сжатия диффузного слоя противоионов и уменьшения абсолютного значения z-потенциала.Коагуляция смесью электролитов имеет большое практическое значение, так как даже при добавлении к золю одного электролита-коагулянта, в действительности коагуляция происходит, по крайней мере, под влиянием двух электролитов, так как в системе содержится электролит-стабилизатор. Кроме того, в технике для коагуляции часто применяют смесь двух электролитов. Понимание закономерностей взаимного действия электролитов важно также при исследовании воздействия биологически активных ионов на органы и ткани живого организма.
При коагуляции золя смесью двух и более электролитов возможны три случая (рис. 3.1.2.3). По оси абсцисс отложена концентрация первого электролита С1, а Cк1 – его порог коагуляции. Аналогично по оси ординат отложена концентрация второго электролита С2, а Ск2 – его порог коагуляции.1. Аддитивное действие электролитов (линия 1 рис. 3.1.2.3). Электролиты действуют как бы независимо один от другого, их суммарное действие складывается из воздействий каждого из электролитов. Если с1´ - концентрация первого электролита, то для коагуляции золя концентрация второго электролита должна быть равной с2´. Аддитивность наблюдается обычно при сходстве коагулирующей способности обоих электролитов.
2. Синергизм действия (линия 2 рис. 3.1.2.3). Электролиты как бы способствуют друг другу – для коагуляции их требуется меньше, чем нужно по правилу аддитивности (с2″ < c2′). Условия, при которых наблюдается синергизм, сформулировать трудно.
3. Антагонизм действия (линия 3 рис. 3.1.2.3). Электролиты как бы противодействуют друг другу и для коагуляции их следует добавить больше, чем требуется по правилу аддитивности. Антагонизм наблюдается при большом различии в коагулирующем действии электролитов.Существует несколько теорий, объясняющих явление антагонизма. Одной из его причин может служить химическое взаимодействие между ионами.Коагуляция золя может быть вызвана его взаимодействием с другим золем, частицы которого имеют противоположный заряд. Так, смешение золя гидроксида железа, частицы которого имеют положительный заряд, с отрицательно заряженным золем сульфида мышьяка приводит к их взаимной коагуляции.В данном случае коагуляция обусловлена тем, что коллоидные частицы одного вида являются как бы очень крупными многозарядными ионами – коагулянтами для частиц другого вида. Взаимная коагуляция коллоидных систем может наблюдаться и тогда, когда частицы золей имеют одноименный заряд; в этом случае причиной потери устойчивости одного из золей является сильная специфическая адсорбция иона – стабилизатора данной системы поверхностью коллоидных частиц другой системы.Старение золей и пептизацияТермодинамическая неустойчивость лиофобных коллоидных систем является причиной старения золей – самопроизвольной коагуляции (автокоагуляции) золей. Автокоагуляция золей происходит значительно медленнее, чем коагуляция электролитами; так, золи золота могут сохраняться без видимых изменений десятилетиями. Одной из основных причин старения золей является медленно совершающийся процесс перекристаллизации вещества ядра.Пептизацией (дезагрегацией) называется процесс расщепления коагулировавшего золя (коагулята) на первичные частицы – процесс, противоположный коагуляции. Пептизация возможна лишь тогда, когда структура частиц в коагуляте не изменена по сравнению с первоначальной (т.е. когда еще не произошло полного сращивания частиц и они слабо связаны друг с другом). Различают непосредственную и опосредованную пептизацию.Непосредственная пептизация происходит в результате добавления к коагуляту электролита, содержащего потенциалопределяющий ион; в результате его специфической адсорбции на поверхности частиц дисперсной фазы их заряд вновь увеличивается, толщина двойного электрического слоя возрастает. Это приводит к тому, что силы отталкивания между частицами начинают преобладать над силами притяжения; происходит дезагрегация – распад образовавшегося ранее агрегата из слипшихся частиц. Опосредованная пептизация вызывается добавлением в систему вещества, химическое взаимодействие которого с поверхностью коагулята приводит к высвобождению потенциалопределяющих ионов. Например, коагулировавший золь гидроксида железа(III) может быть пептизирован добавлением в систему либо какой-либо соли железа (непосредственная пептизация), либо соляной кислоты (опосредованная пептизация).
Дата добавления: 2016-01-16; просмотров: 2710;
