Молекулярно-кинетические свойства коллоидных систем: броуновское движение, диффузия, осмотическое давление.
К молекулярно-кинетическим свойствам свободнодисперсных систем относятся: броуновское движение, диффузия, осмотическое давление, седиментация.
Броуновское движение проявляется хаотическим непрерывным движением частиц дисперсной фазы под действием ударов молекул растворителя (дисперсионной среды), находящихся в состоянии интенсивного молекулярно-теплового движения. Перемещаться частицы могут в различных направлениях. Траектория их движения представляет собой ломаную линию неопределенной конфигурации (рис.31).
 К оличественной мерой перемещения частицы при броуновском движении является величина её среднего смещения за некоторый промежуток времени. Смещением или сдвигом частицы называют расстояние между проекциями начальной (1) и конечной (2) точек траектории на ось смещений. А.Эйнштейн и М.Смолуховский установили, что квадрат среднего смещения равен:
К оличественной мерой перемещения частицы при броуновском движении является величина её среднего смещения за некоторый промежуток времени. Смещением или сдвигом частицы называют расстояние между проекциями начальной (1) и конечной (2) точек траектории на ось смещений. А.Эйнштейн и М.Смолуховский установили, что квадрат среднего смещения равен:
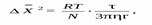
где ΔX – среднее смещение частицы, м–1; R – газовая постоянная, равная 8,31 Дж×моль/К; Т – температура, К; N – число Авогадро, моль–1; τ – время смещения, с; η – вязкость дисперсионной среды, Н×c/м2; r – радиус дисперсной частицы, м.Из этого уравнения следует, что броуновское движение тем интенсивнее, чем меньше размер частиц и вязкость среды и чем выше температура. Броуновское движение не прекращается со временем, т.е. не зависит от длительности существования системы.
Диффузия – это самопроизвольно протекающий процесс выравнивания концентраций ионов, молекул или коллоидных частиц вследствие их беспорядочного теплового (для истинных растворов) или броуновского (для дисперсных систем) движения. Диффузия заканчивается с достижением равномерного распределения частиц по всему объему. Следовательно, диффузия возможна лишь в системах с неодинаковыми концентрациями.Величина, показывающая количество вещества, диффундирующего через поперечное сечение площадью 1 м2 за 1 секунду при градиенте концентраций равном 1, называется коэффициентом диффузии.По формуле Стокса–Эйнштейна коэффициент диффузии связан с размерами диффундирующих частиц уравнением:
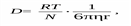
где D – коэффициент диффузии, м2/с.
Из этого уравнения следует, что чем больше размер частиц и выше вязкость среды, тем меньше скорость диффузии. Следовательно, при одинаковой температуре скорость диффузии в коллоидных растворах в сотни и тысячи раз меньше, чем в истинных растворах.
Осмотическое давление –одно из коллигативных свойств растворов, т.е. зависит только от количества свободно движущихся частиц. Следовательно, оно характерно, как для коллоидных растворов, так и для истинных, и для расчета величины осмотического давления коллоидных растворов также можно применить уравнение Вант-Гоффа:
Росм. = 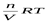 ,
,
где Росм. – осмотическое давление золя, Па; n – количество частиц, моль; V– объем золя, м3; R– газовая постоянная; Т– температура, К.
Если учесть, что объем и масса коллоидной частицы значительно больше, чем объем и масса молекулы низкомолекулярных веществ, то при одной и той же массовой концентрации вещества, в единице объема золя содержится значительно меньше частиц, чем в единице объема истинного раствора. Поэтому осмотическое давление коллоидных растворов ничтожно мало по сравнению с таковым в истинных растворах. Например, осмотическое давление золя золота с массовой концентрацией вещества 10 г/л равно 45 Па, а раствора сахарозы той же концентрации и в тех же условиях – 72500 Па.
Второй особенностью осмотического давления коллоидных растворов является его непостоянство. В связи с термодинамической неустойчивостью коллоидных растворов в них непрерывно протекают процессы агрегации и дезагрегации, приводящие к изменению числа осмотически активных частиц в единице объема, а, следовательно, и осмотического давления.
75.Классификация коллоидных систем. Механизм возникновения электрического заряда коллоидной частицы. Строение двойного электрического слоя. Мицелла. Ядро. Гранула.
Коллоидные системы относятся к дисперсным системам – системам, где одно вещество в виде частиц различной величины распределено в другом (см. разд. 4.1). Дисперсные системы чрезвычайно многообразны; практически всякая реальная система является дисперсной. Дисперсные системы классифицируют прежде всего по размеру частиц дисперсной фазы (или степени дисперсности); кроме того, их разделяют на группы, различающиеся по природе и агрегатному состоянию дисперсной фазы и дисперсионной среды.
Если дисперсионной средой является жидкость, а дисперсной фазой – твердые частицы, система называется взвесью или суспензией; если дисперсная фаза представляет собой капельки жидкости, то систему называют эмульсией. Эмульсии, в свою очередь, подразделяют на два типа:прямые, или "масло в воде" (когда дисперсная фаза – неполярная жидкость, а дисперсионная среда – полярная жидкость) и обратные, или "вода в масле" (когда полярная жидкость диспергирована в неполярной). Среди дисперсных систем выделяют также пены (газ диспергирован в жидкости) и пористые тела (твердая фаза, в которой диспергированы газ либо жидкость). Основные типы дисперсных систем приведены в табл.1.
По степени дисперсности выделяют обычно следующие классы дисперсных систем:
Грубодисперсные системы – системы, размер частиц дисперсной фазы в которых превышает 10-7м.
Коллоидные системы – системы, размер частиц дисперсной фазы в которых составляет 10-7 – 10-9м. Коллоидные системы характеризуются гетерогенностью, т.е. наличием поверхностей раздела фаз и очень большим значением удельной поверхности дисперсной фазы. Это обусловливает значительный вклад поверхностной фазы в состояние системы и приводит к появлению у коллоидных систем особых, присущих только им, свойств.
Двойной электрический слой (межфазный) (ДЭС) — слой ионов, образующийся на поверхности частиц в результате адсорбции ионов из раствора, диссоциации поверхностного соединения или ориентирования полярных молекул на границе фаз. Ионы, непосредственно связанные с поверхностью называются потенциалоопределяющими. Заряд этого слоя компенсируется зарядом второго слоя ионов, называемых противоионами.
В отсутствие теплового движения частиц, строение двойного электрического слоя подобно строению плоского конденсатора. Но в отличие от идеального случая, ДЭС в реальных условиях имеет диффузное (размытое) строение. Согласно современной теории структуру ДЭС составляют два слоя:Слой Гельмгольца или адсорбционный слой, примыкающий непосредственно к межфазной поверхности. Этот слой имеет толщину δ, равную радиусу потенциалопределяющих ионов внесольватированном состояниДиффузный слой или слой Гуи, в котором находятся противоионы. Диффузный слой имеет толщину λ, которая зависит от свойств системы и может достигать больших значений. Толщина диффузного слоя рассчитывается по формуле:
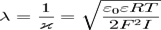
Электрической характеристикой ДЭС является потенциал φ. Существует несколько характеристических потенциалов:Потенциал диффузного слоя φδ, соответствующий границе адсорбционного и диффузного слоёв. Внутри диффузного слоя потенциал можно рассчитать по уравнению Гуи-Чепмена:
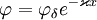
· Потенциал φx=λ, меньший, чем φδ в e раз и характеризующий толщину диффузного слоя.Электрокинетический потенциал или дзета-потенциал. Этот потенциал соответствует плоскости скольжения и является частью потенциала диффузного слоя. Плоскость скольжения образуется в результате того, что при движении дисперсных частиц наиболее удаленная часть диффузного слоя не участвует в движении, а остается неподвижной. Поэтому появляется нескомпенсированность поверхностного заряда частицы и становятся возможными электрокинетические явления. Дзета-потенциал является одной из важнейших характеристик двойного электрического слоя.
- Кол. частица состоит из ядра, адсорбирующего из окруж. среды иона другого вида, эти ионы наз-ся зарядообразующими. Ядро кол. частицы притягивает к себе из среды ионы противопол. знака. все сочетание, сост. из кол. частицы и эквивал-ой ей части дисперсной среды, наз-сямицеллой.Т.е, мицелла:-ядро -адсорбирующий слой-слой противоионовКол. частица — это мицелла и диффузионный слой противоионов.
- Оптич. св-во:Если пропускать пучок света через совершенно прозрачный кол. раствор, то он станов. видимым.
- Элект. св-во:Частицы дисперсной фазы перемещаются к аноду при возд.пост.эл.тока, а частицы дисперсионной среды — к катоду. Дисп. фаза несет на себе заряд противоп.заряду среды.
- Ионы адсорбционного слоя сравнительно прочно связаны с агрегатом, а противоионы диффузного слоя находятся под действием двух факторов: электростатического притяжения ионами противоположного заряда, которое удерживает их вблизи ядра, и броуновского движения, стремящегося распределить их в дисперсионной среде.
- Ядро вместе с противоионами адсорбционного слоя составляет коллоидную частицу, или гранулу. Гранула с противоионами диффузного слоя называетсямицеллой. Следует иметь в виду, что знак заряда гранулы соответствует знаку заряда потенциалопределяющих ионов. Мицелла в отличие от гранулы электронейтральна.
- Строение мицеллы и заряд гранулы зависят от способа получения коллоидного раствора. Если медленно приливать разбавленный раствор нитрата серебра к раствору хлорида натрия, взятому в избытке, то на поверхности агрегата n(AgCl) будут адсорбироваться хлорид-ионы, имеющиеся в растворе в избытке (образуется слой потенциалопределяющих ионов), а в качестве противоионов адсорбционного и диффузионного слоев будут выступать ионы натрия. Состав мицеллы полученного гидрозоля записывается формулой:
- {n(AgCl), mCl–, (m – x)Na+}x–xNa+.
- Основу мицеллы составляет нерастворимое в данной среде ядро, микрокристалл или совокупность микрокристаллов.
- Механизмы образования двойного электрического слоя
- Существуют следующие механизмы образования двойного электрического слоя:
- 1) Ионизация поверхности. Металл теряет электроны и заряжается положительно.
- 2) Избирательная адсорбция ионов. Поверхность адсорбирует ион более близкий по природе.
- 3) Образование двойного электрического слоя за счёт адсорбции на поверхности полярных молекул. Правило Кёна: положительно заряжается та фаза, которая имеет большую диэлектрическую проницаемость.
Дата добавления: 2016-01-16; просмотров: 5308;
