Кинетика параллельных химических реакций
1. Рассмотрим две параллельные реакции, протекающие, например, при разложении вещества А с образованием веществ В и Д
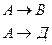
Обе стадии процесса протекают как реакции первого порядка. Согласно основному постулату химической кинетики скорость реакции или скорость превращения вещества А равна сумме скоростей по обоим направлениям.
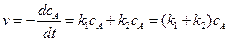 , (4.86)
, (4.86)
или
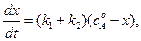 (4.87)
(4.87)
где 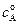 - начальная концентрация вещества А, х – изменение концентрации вещества А или общая концентрация продуктов реакции ( при
- начальная концентрация вещества А, х – изменение концентрации вещества А или общая концентрация продуктов реакции ( при 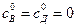 ).
).
Разделив переменные, получим:
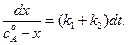 (4.88)
(4.88)
Интегрируя это уравнение в пределах от 0 до t и от х=0 до х, получим:
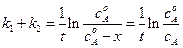 . (4.89)
. (4.89)
Полученное уравнение имеет тот же вид, что и уравнение для необратимой реакции первого порядка. Из этого уравнения следует, что
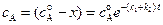 (4.90)
(4.90)
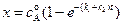 . (4.91)
. (4.91)
Скорости образования веществ В и Д равны:
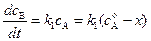 ; (4.92)
; (4.92)
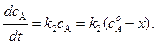 (4.93)
(4.93)
Подставляя в полученные уравнения выражение (4.90) для 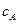 и разделив переменные получим:
и разделив переменные получим:
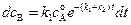 (4.94)
(4.94)
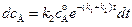 (4.95)
(4.95)
Интегрирование этих уравнений в пределах от 0 до t и, соответственно, от 0 до  и
и 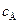 дает:
дает:
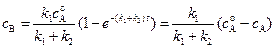 ; (4.96)
; (4.96)
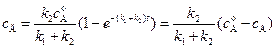 . (4.97)
. (4.97)
Выражение для 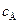 можно получить также из уравнения материального баланса (
можно получить также из уравнения материального баланса ( 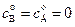 ):
): 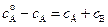 . Отсюда
. Отсюда 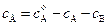 . Подставляя в это уравнение выражение для
. Подставляя в это уравнение выражение для 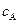 и
и  получим выражение (4.97).
получим выражение (4.97).
Интегральной селективностью процесса при наличии параллельных реакций называется отношение концентрации основного продукта к сумме концентраций всех продуктов, полученных в результате реакции.
Если считать вещество В основным (полезным) продуктом, а вещество Д побочным, то можно найти интегральную селективность реакции относительно вещества В (sВ)
sВ 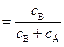 . (4.98)
. (4.98)
Из уравнений (4.96 и 4.97) видно, что экспериментальным критерием того, что реакция протекает по механизму параллельных процессов, является то, что отношение концентраций продуктов реакции есть величина постоянная в любой момент времени протекания процесса:
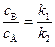 . (4.99)
. (4.99)
Отсюда значение интегральной селективности реакции равно:
s = 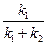 . (4.100)
. (4.100)
Как видно из уравнения (4.100), селективность параллельно протекающих реакций остается постоянной в течение всего процесса.
При решении обратной кинетической задачи, значение 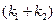 можно определить по тангенсу угла наклона графической зависимости
можно определить по тангенсу угла наклона графической зависимости 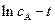 . Так как
. Так как 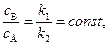 то, зная (
то, зная ( 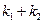 ) и концентрации
) и концентрации  и
и 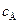 в любой момент времени, можно определить
в любой момент времени, можно определить 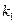 и
и 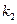 из уравнений (4.96) и (4.97).
из уравнений (4.96) и (4.97).
2.Рассмотрим случай, когда параллельные реакции являются реакциями второго порядка.
Такой процесс можно представить общей схемой:
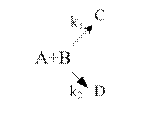
Кинетическое уравнение в дифференциальной форме можно представить как:
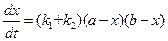 . (4.101)
. (4.101)
Интегрирование этого уравнения позволяет оценить сумму констант скоростей:
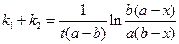 . (4.102)
. (4.102)
Отношение концентраций продуктов, как и в первом случае, не зависит от времени и определяется отношением констант скоростей
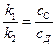 . (4.103)
. (4.103)
Следует отметить, что часто встречаются параллельные реакции второго порядка и параллельные, двусторонние реакции, как первого, так и второго порядка. Для математического описания кинетики таких реакций, используя основные положения формальной кинетики, составляют систему дифференциальных уравнений, характеризующих скорости образования отдельных реагентов. Решение таких систем дифференциальных уравнений осуществляется численными методами с использованием ЭВМ.
Дата добавления: 2016-01-09; просмотров: 1265;
