Примеры решения задач. Пример 1. Константа скорости некоторой реакции с увеличением температуры изменялась следующим образом: t1 = 20°С;
Пример 1. Константа скорости некоторой реакции с увеличением температуры изменялась следующим образом: t1 = 20°С;
k1 = 2,76 10-4 мин.-1; t2 = 50 0С; k2= 137,4 10-4 мин.-1 Определить температурный коэффициент константы скорости химической реакции.
Решение. Правило Вант –Гоффа позволяет рассчитать температурный коэффициент константы скорости по соотношению
gn = 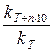 =2 ¸ 4, где n =
=2 ¸ 4, где n = 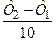 =
= 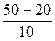 =3;
=3;
g3 = 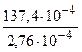 =49,78 g = 3,68
=49,78 g = 3,68
Пример 2.С помощью правила Вант-Гоффа вычислить, при какой температуре реакция закончится за 15 мин., если при температуре 20 0С потребовалось 120 мин. Температурный коэффициент скорости реакции равен 3.
Решение. Очевидно, чем меньше время протекания реакции (t), тем больше константа скорости реакции:
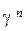 =
= 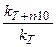 =
= 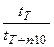 =
= 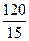 ;
;
3n = 8, nln3 = ln8, n= 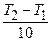 =
= 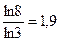 .
.
Температура, при которой реакция закончится за 15 минут, равна:
20 + 1,9×10 = 39 0С.
Пример 3.Константа скорости реакции омыления уксусно-этилового эфира раствором щелочи при температуре 282,4 К равна2,37л2/моль2мин., а при температуре 287,40 К равна 3,2л2/моль2мин. Найти, при какой температуре константа скорости данной реакции равна 4?
Решение.
1. Зная значения констант скоростей при двух температурах, можно найти энергию активации реакции:
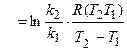 =
= 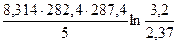 = 40,8 кДж/моль.
= 40,8 кДж/моль.
2. Зная значение энергии активации, из уравнения Аррениуса
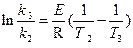 ,
,
можно рассчитать Т3 – температуру, при которой k3 = 4.
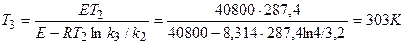 .
.
Вопросы и задания для самоконтроля.
1.Какие величины называются «аррениусовскими» параметрами?
2.Какой минимум опытных данных необходим для расчета энергии активации химической реакции?
3. Покажите, что температурный коэффициент константы скорости зависит от температуры.
4. Существуют ли отклонения от уравнения Аррениуса? Как можно описать зависимость константы скорости от температуры в этом случае?
Дата добавления: 2016-01-09; просмотров: 8715;
