Зависимость константы скорости реакции от температуры
Скорость большинства химических реакций возрастает при повышении температуры. Так как концентрация реагирующих веществ, практически не зависит от температуры, то в соответствии с кинетическим уравнением реакции 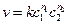 основное влияние температуры на скорость реакции осуществляется через изменение константы скорости реакции. При увеличении температуры возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение.
основное влияние температуры на скорость реакции осуществляется через изменение константы скорости реакции. При увеличении температуры возрастает энергия сталкивающихся частиц и повышается вероятность того, что при столкновении произойдет химическое превращение.
Зависимость скорости реакции от температуры можно характеризовать величиной температурного коэффициента 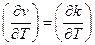 .
.
Экспериментальные данные по влиянию температуры на скорость многих химических реакций при обычных температурах (273–373 К), в небольшом интервале температур показали, что повышение температуры на 10 градусов увеличивает скорость реакции в 2-4 раза (правило Вант-Гоффа).
По Вант-Гоффу- температурный коэффициент константы скорости (коэффициент Вант-Гоффа) – это возрастание скорости реакции при увеличении температуры на 10 градусов.
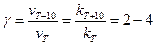 (4.63)
(4.63)
где 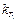 и
и 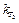 — константы скорости при температурах
— константы скорости при температурах 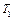 и
и 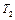 ;
; 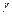 — температурный коэффициент скорости реакции.
— температурный коэффициент скорости реакции.
При повышении температуры на n десятков градусов отношение констант скоростей будет равно
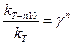 , (4.64)
, (4.64)
где n может быть как целым, так и дробным числом.
Правило Вант-Гоффа это приближенное правило. Оно применимо в узком интервале температур, так как температурный коэффициент изменяется с температурой.
Более точная зависимость константы скорости реакции от температуры выражается полуэмпирическим уравнением Аррениуса
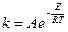 (4.65)
(4.65)
где А - предэкспоненциальный множитель который не зависит от температуры, а определяется только видом реакции; Е – энергия активации химической реакции. Энергию активации можно представить как некоторую пороговую энергию, характеризующую высоту энергетического барьера на пути реакции. Энергия активации также не зависит от температуры.
Эта зависимость установлена в конце XIX в. голландским ученым Аррениусом для элементарных химических реакций.
Энергия активации прямой (Е1 ) и обратной (Е2 ) реакции связана с тепловым эффектом реакции DН соотношением (см. рис 1):
Е1 – Е2 = DН.
Если реакция эндотермическая и DН> 0, то Е1 > Е2 и энергия активации прямой реакции больше обратной. Если реакция экзотермическая, то Е1 < Е2.
Уравнение Аррениуса (101) в дифференциальной форме можно записать:
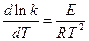 . (4.66)
. (4.66)
Из уравнения следует, что чем больше энергия активации Е, тем быстрее растет скорость реакции с температурой.
Разделив переменные k и T и, считая E постоянной величиной, после интегрирования уравнения (4.66) получим:
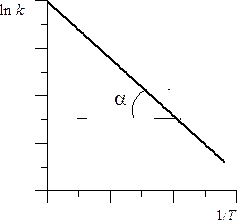
Рис. 5. График lnk –1/T.
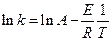 , (4.67)
, (4.67)
где А – предэкспоненциальный множитель, имеющий размерность константы скорости. Если это уравнение справедливо, то на графике в координатах 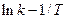 опытные точки располагаются на прямой линии под углом a к оси абсцисс и угловой коэффициент (
опытные точки располагаются на прямой линии под углом a к оси абсцисс и угловой коэффициент ( 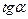 ) равен
) равен 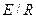 , что позволяет рассчитать энергию активации химической реакции по зависимости константы скорости от температуры по уравнению
, что позволяет рассчитать энергию активации химической реакции по зависимости константы скорости от температуры по уравнению 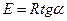 .
.
Энергию активации химической реакции можно вычислить по значениям констант скоростей при двух различных температурах по уравнению
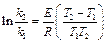 . (4.68)
. (4.68)
Теоретический вывод уравнения Аррениуса сделан для элементарных реакций. Но опыт показывает, что подавляющее большинство сложных реакций также подчиняются этому уравнению. Однако для сложных реакций энергия активации и предэкспоненциальный множитель в уравнении Аррениуса не имеют определенного физического смысла.
Уравнение Аррениуса (4.67) позволяет дать удовлетворительное описание большого круга реакций в узком температурном интервале.
Для описания зависимости скорости реакции от температуры применяют также модифицированное уравнение Аррениуса
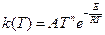 ,(4.69)
,(4.69)
в которое входят уже три параметра:А, Е и n.
Уравнение (4.69) широко используется для реакций, протекающих в растворах. Для некоторых реакций зависимость константы скорости реакции от температуры отличается от приведенных выше зависимостей. Так, например, в реакциях третьего порядка константа скорости убывает с увеличением температуры. В цепных экзотермических реакциях константа скорости реакции резко возрастает при температуре выше некоторого предела (тепловой взрыв).
Дата добавления: 2016-01-09; просмотров: 1451;
