Гидроксиды и соли хрома (II) и (III). Комплексные соединения хрома (III)
Гидроксид хрома (II) Cr(ОН)2 получают в виде желтого осадка, обрабатывая растворы солей хрома (II) щелочами в отсутствие кислорода:
CrСl2+2NaOH=Cr(OH)2¯+2NaCl
Cr(OH)2 обладает типичными основными свойствами и является сильным восстановителем:
2Cr(OH)2+H2O+1/2O2 =2Cr(OH)3¯
Водные растворы солей хрома (II) получают без доступа воздуха растворением металлического хрома в разбавленных кислотах в атмосфере водорода или восстановлением цинком в кислой среде солей трехвалентного хрома. Безводные соли хрома (II) белого цвета, а водные растворы и кристаллогидраты — синего цвета.
По своим химическим свойствам соли хрома (II) похожи на соли двухвалентного железа, но отличаются от последних более ярко выраженными восстановительными свойствами, т.е. легче, чем соответствующие соединения двухвалентного железа, окисляются. Именно поэтому очень трудно получать и хранить соединения двухвалентного хрома.
Гидроксид хрома (III) Cr(ОН)3 — студнеобразный осадок серо-зеленого цвета, его получают при действии щелочей на растворы солей хрома (III):
Cr2(SO4)3+6NaOH=2Cr(OH)3¯+3Na2SO4
Гидроксид хрома (III) обладает амфотерными свойствами, растворяясь как в кислотах с образованием солей хрома (III):
2Cr(ОН)3+3H2SO4=Cr2(SO4)3+6Н2О так и в щелочах с образованием гидроксихромитов: Cr(OH)3+NaOH=Na3[Cr(OH)6]
При сплавлении Cr(ОН)3 с щелочами образуются метахромиты и ортохромиты:
Cr(ОН)3+NaOH=NaCrO2+2Н2O Cr(ОН)3+3NaOH=Na3CrO3+3Н2О
При прокаливании гидроксида хрома (III) образуется оксид хрома (III):
2Cr(ОН)3=Cr2O3+3Н2O
Соли трехвалентного хрома как в твердом состоянии, так и в водных растворах окрашены. Например, безводный сульфат хрома (III) Cr2(SO4)3 фиолетово-красного цвета, водные растворы сульфата хрома (III) в зависимости от условий могут менять цвет от фиолетового до зеленого. Это объясняется тем, что в водных растворах катион Cr3+ существует только в виде гидратированного иона [Cr(Н2O)6]3+ благодаря склонности трехвалентного хрома к образованию комплексных соединений. Фиолетовый цвет водных растворов солей хрома (III) обусловлен именно катионом [Cr(Н2О)6]3+. При нагревании комплексные соли хрома (III) могут
частично терять воду, образуя соли различного цвета, вплоть до зеленого.
Соли трехвалентного хрома сходны с солями алюминия по составу, строению кристаллической решетки, по растворимости; так, для хрома (III) так же, как и для алюминия, типично образование хромокалиевых квасцов KCr(SO4)2•12Н2О, их применяют для дубления кож и в качестве протравы в текстильном деле.
Соли хрома (III)Cr2(SО4)3, CrСl3 и т.д. при хранении на воздухе устойчивы, а в растворах подвергаются гидролизу:
Cr3++3Сl-+НОН«Cr(ОН)2++3Сl-+Н+
Гидролиз идет по I ступени, но есть соли, которые гидролизуются нацело:
Cr2S3+Н2O=Cr(OH)3¯+H2S
В окислительно-восстановительных реакциях в щелочной среде соли хрома (III) ведут себя как восстановители:
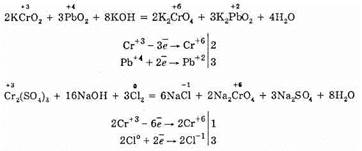
Следует отметить, что в ряду гидроксидов хрома различных степеней окисления Cr(ОН)2 — Cr(ОН)3 — Н2CrО4 закономерно происходит ослабление основных свойств и усиление кислотных. Такое изменение свойств обусловлено увеличением степени окисления и уменьшением ионных радиусов хрома. В этом же ряду последовательно усиливаются окислительные свойства. Соединения Cr (II) — сильные восстановители, легко окисляются, превращаясь в соединения хрома (III). Соединения хрома(VI) — сильные окислители, легко восстанавливаются в соединения хрома (III). Соединения с промежуточной степенью окисления, т.е. соединения хрома (III), могут при взаимодействии с сильными восстановителями проявлять окислительные свойства, переходя в соединения хрома (II), а при взаимодействии с сильными окислителями проявлять восстановительные свойства, превращаясь в соединения хрома (VI).
Дата добавления: 2016-01-03; просмотров: 11800;
